서 론
재료 및 방법
추출물 제조
실험동물 및 식이조제
체중 증가량 및 식이 섭취량 조사
혈중 총 활성산소발생량 및 총 항산화능 측정
통계분석
결과 및 고찰
체중 증가량 및 식이 섭취량
장기 무게 변화
혈중 총 활성산소발생량 및 총 항산화능 변화
요 약
서 론
호기성 생명체들은 산소를 이용하여 에너지 대사를 진행하며 살아가고 있으며, 체내로 섭취된 산소의 약 95% 이상은 세포의 에너지 대사과정에서 생성되는 전자와 결합하여 물로 환원되지만, 1–3%는 물리적, 화학적, 생물학적인 요인에 의하여 superoxide anion radical, hydrogen peroxide, hydroxyl free radcial 등의 다양한 활성산소종을 생성한다(Andreyev et al., 2005). 이들 활성산소들은 세포내 과립(peroxisome, microsome, mitochondria)에서 생성되어 대식세포의 살균작용으로 세균 등의 이물질로부터 신체를 보호하고 오래된 단백질 제거 등에 유익한 기능을 하는 반면, 반응성이 매우 빠르고 커 생체 내 유해한 작용도 갖는 것으로 보고된 바 있다(Valko et al., 2006; Halliwell et al., 1987). 반응성이 빠르고 큰 활성산소는 당, 지질, 단백질, DNA 등과 반응하여 당과 지질의 산화와 단백질의 변성뿐만이 아니라 효소의 불활성화, DNA의 절단(Formica and Regelson, 1995; Hertog and Hollman, 1996) 등의 손상을 일으켜 여러 가지 질환들인 동맥 경화증(Ness and Powles, 1997), 류마티스 성 관절염(Block and Langseth, 1994), 염증(Middleton et al., 2000) 등 각종 성인병(Serdula et al., 1996)과 암(Hertog et al., 1993)을 유발시키는 원인으로 알려져 있으며, 또한 노화를 촉진시키는 것으로도 알려져 있다(Choi et al., 2019).
생체 내에서는 항산화 방어시스템이 효율적으로 구성되어 있어 활성산소로부터 세포를 보호하고 활성산소의 생성과 제거가 균형을 유지하도록 한다. 흡연이나, 스트레스, 음주 및 여러 가지 공해물질등에 신체가 지속적으로 노출이 되면 체내의 활성산소 생성을 촉진시켜 여러 가지 만성 퇴행성질환을 유발하기 때문에 항산화 방어 시스템에 효능을 가지고 있는 천연물소재 추출물에 대한 중요성이 인정되어 이에대한 연구가 활발히 진행되고 있다(Lee and Lee, 2016; Kim et al., 1999).
한편 현사시나무(Populus Tomentiglandulosa)는 버드나무과(Salicaceae)에 속하며 조경수와 가로수 식재용으로 널리 보급하기 위해 은백양나무와 수원사시나무를 우리나라에서 인공 교배한 수종으로 본 연구진에서는 현사시나무 추출물에 대하여 일반성분, 무기질, 비타민, 유리당, 총페놀, 총플라보노이드 및 페놀성 화합물에 대한 성분분석과 in vitro 항산화 활성을 측정하여 보고한 바 있다(Choi et al., 2020). 본 연구에서는 현사시나무 70% 에탄올 추출물의 in vivo 항산화 활성 탐색을 위하여 sprague-dawley 웅성 rat를 이용하여 AIN-diet 조성에 현사시나무 70% 에탄올 추출물을 0.5% 수준으로 첨가하여 4주간 급여한 후, 혈중 총 활성산소발생량과 총 항산화능에 미치는 영향을 조사하였다.
재료 및 방법
추출물 제조
본 연구 사용한 현사시나무 추출물의 제조는 Choi et al. (2020)의 방법에 따라 제조하였다. 즉, 현사시나무는 춘천시 동산면의 야산에서 채취한 후, 수피를 분리하여 70% 에탄올에 침지(70°C에서 24시간)시켜 추출하였다. 상기 추출 과정을 3회 반복하였으며 Whatman No. 1 여과지(Whatman Ltd., Maidstone, Kent, UK)를 이용하여 여과한 후, 진공회전농축기(EYELA, SN-1100, Tokyo, Japan)를 사용하여 50°C에서 감압농축하였다. 농축된 추출물은 동결건조기(PVTFA10AT, Ilsin, Dongducheon, Korea)를 이용하여 분말화 하였으며 추출수율(%)은 7.78%로 나타났다.
실험동물 및 식이조제
현사시나무 70% 에탄올 추출물 in vivo 실험을 위하여 S.D.계 웅성 rat으로 5주령 36마리를 폴라스인터내셔날(Seoul, Korea)에서 구입하였다. 일반 사육용 사료로 사육환경에 적응시키며 예비사육기간 동안 무게를 측정하여 정상식이군(음성대조군), ascorbic acid군(양성대조군), 현사시나무 70% 에탄올 추출물 군으로 각 군당 9마리씩 분류한 후 4주간 해당식이로 stainless steel wire cage에서 한 마리씩 분리 사육하였다. 사육실 내의 습도는 50 ± 5%, 온도는 23 ± 1°C, 환기 및 조도를 자동으로 조절하였으며 점등과 소등을 12시간 간격으로 실시하였다. 실험기간 중 물은 증류수를 섭취하게 하였으며 식이는 자유급여(adlibitum) 하였다. American Institute of Nutrition(AIN)(American Institute of Nutrition, 1977)에서 권장한 식이 조성에 따라 현사시나무 70% 에탄올 추출물을 혼합하여 조제하였으며 Table 1과 같다.
Table 1.
Composition of experimental diets (unit : %)
식이 조제에 사용한 casein, AIN-76 vitamin mix, AIN-76 mineral mix, cholesterol, choline bitatrate, corn starch, cellulose, DL-methionine은 ICN Biochemicals(MP Biomedical, Ohio, USA)제품을 사용하였고 sucrose 및 corn oil은 CJ(CJ, Seoul, Korea)의 제품을 사용하였다.
체중 증가량 및 식이 섭취량 조사
체중은 3일 간격으로 일정한 시각에 측정하였고, 측정 2시간 전에 식이 통을 제거하여 식이 섭취로 인한 일시적인 체중변화를 막았다. 식이 섭취량은 2일 간격으로 제공한 식이 무게에서 잔량을 뺀 값으로 섭취량을 계산하였다. 또한 식이효울(food efficiency ratio)은 4주간의 체중 증가량을 4주간의 식이섭취량으로 나눈 값으로 계산하였다.
혈중 총 활성산소발생량 및 총 항산화능 측정
혈액중의 총항산화능 및 활성산소 발생량은 활성산소 항산화력 자동분석기(FRAS 4, H&D, Parma, Italy)를 사용하여 측정하였고 2주 간격으로 측정하였다. 활성산소측정은 혈액중의 활성산소의 산화작용으로 형성된 과산화물을 생성을 측정하는 d-ROM(reactive oxygen metabolites) test kit(Diacron, Grosseto, Italy)를 이용하였으며 쥐꼬리에서 채취한 혈액을 흡광용 큐빅에 넣고 FRAS 4에 꽂은 후 37°C에서 5분후에 활성산소 값을 측정하여 Unit Carratelli (UCARR, 1 UCARR = 0.08 mg/100 mL H2O2)으로 나타내었다. 쥐꼬리에서 채취한 혈액을 원심분리하여 얻은 혈청의 항산화능을 측정하기 위해 Fe+3에서 Fe+2로의 환원력을 측정하는 BAP(biological antioxidant potential) test kit(Diacron, Grosseto, Italy)를 이용하여 측정하였다.
통계분석
모든 결과는 statistical analysis system(SAS) program(ver 9.4, SAS Institute Inc., Cart, NC, USA)과 다중 범위 검정(Duncan's multiple range test)을 이용하여 p < 0.05 수준에서 실험군 간의 유의성을 검정하였다.
결과 및 고찰
체중 증가량 및 식이 섭취량
현사시나무 70% 에탄올 추출물을 실험동물인 rat의 AIN-diet 조성에 0.5% 수준으로 첨가하여 정상식이만 첨가한 음성대조군과 ascorbic acid을 첨가한 양성대조군과 함께 각각 1마리씩 사육 cage에서 4주간 각각의 식이로 사육한 후, 체중 증가량과 식이 효율을 측정한 결과는 Table 2와 같다. 각각의 식이로 4주간 급여 후 체중 증가량을 측정한 결과 음성대조군은 50.0 ± 13.18 g/4 week, 양성대조군은 54.5 ± 17.40 g/4 week 이었고 현사시나무 추출물 급여군은 55.9 ± 16.25 g/4 week으로 현사시나무 추출물 급여군과 양성대조군이 음성대조군보다 유의적으로 높은 체중 증가량을 보였다. 식이섭취량 측정 결과 음성대조군과 양성대조군 및 현사시나무 추출물 급여군은 각각 434.1 ± 29.67 g/4 week, 413.7 ± 37.3 g/4 week, 442.39 ± 52.55 g/4 week 으로 각 군간의 통계적인 유의성은 나타나지 않았다. 체중 증가량을 식이 섭취량으로 나눈 값인 식이 효율 측정 결과에서는 대조군과 양성대조군은 각각 0.115 ± 0.023, 0.132 ± 0.036 이었고 0.126 ± 0.029 으로 음성대조군과 양성대조군보다 높았으나 각 군간의 통계적인 유의성은 보이지 않았다. 이러한 결과를 미뤄 볼 때 현사시나무 추출물은 체중증가 및 감소, 식이효율의 변화에 큰 영향을 미치지 않는 것으로 나타났다.
Table 2.
Weight gain, food intake, and food efficiency ratios of rats
| Negative control | Positive control | Populus tomentiglandulosa 70% ethanol extracts | |
| Initial body weight (g) | 110.7 ± 17.47a | 110.2 ± 11.54a | 110.9 ± 12.36a |
| Final body weight (g) | 160.7 ± 9.65a | 164.7 ± 13.20a | 166.8 ± 18.50a |
| Weight gain (g/4week) | 50.0 ± 13.18b | 54.5 ± 17.40a | 55.9 ± 16.25a |
| Food intake (g/4week) | 434.1 ± 29.67a | 413.7 ± 37.30a | 443.0 ± 92.55a |
| Food efficiency ratio | 0.115 ± 0.023a | 0.132 ± 0.036a | 0.126 ± 0.029a |
장기 무게 변화
4주간 식이 급여 후 실험군간 장기무게를 측정하여 체중 100 g에 대한 weight index(%)의 값은 Table 3과 같다. 음성대조군과 양성대조군 및 현사시나무 추출물 급여군의 심장 weight index는 각각 0.45 ± 0.035%, 0.40 ± 0.056%, 0.47 ± 0.099% 으로 각 군간의 통계적인 유의성은 보이지 않았다. 음성대조군과 양성대조군 및 현사시나무 추출물 급여군의 신장 weight index는 각각 1.16 ± 0.118%, 1.15 ± 0.149%, 1.15 ± 0.110% 으로 각 군간의 통계적인 유의성은 보이지 않았다. 음성대조군과 양성대조군 및 현사시나무 추출물 급여군의 간 weight index는 각각 3.23 ± 0.213, 2.93 ± 0.191, 3.11 ± 0.248% 으로 각 군간의 통계적인 유의성은 보이지 않았다. 음성대조군과 양성대조군 및 현사시나무 추출물 급여군의 비장 weight index는 각각 0.16 ± 0.033%, 0.16 ± 0.032%, 0.16 ± 0.031% 으로 각 군간의 통계적인 유의성은 보이지 않았다.
Table 3.
Weight index of rats fed experimental diets for 4 weeks
| Internal organs | Negatiove control | Positive control | Populus tomentiglandulosa 70% ethanol extracts | |
| Weight index (%) | Heart | 0.45 ± 0.035a | 0.40 ± 0.056a | 0.45 ± 0.048a |
| Kidney | 1.16 ± 0.118a | 1.15 ± 0.149a | 1.15 ± 0.110a | |
| Liver | 3.23 ± 0.213a | 2.93 ± 0.191a | 3.11 ± 0.248a | |
| Spleen | 0.16 ± 0.033a | 0.16 ± 0.032a | 0.16 ± 0.031a | |
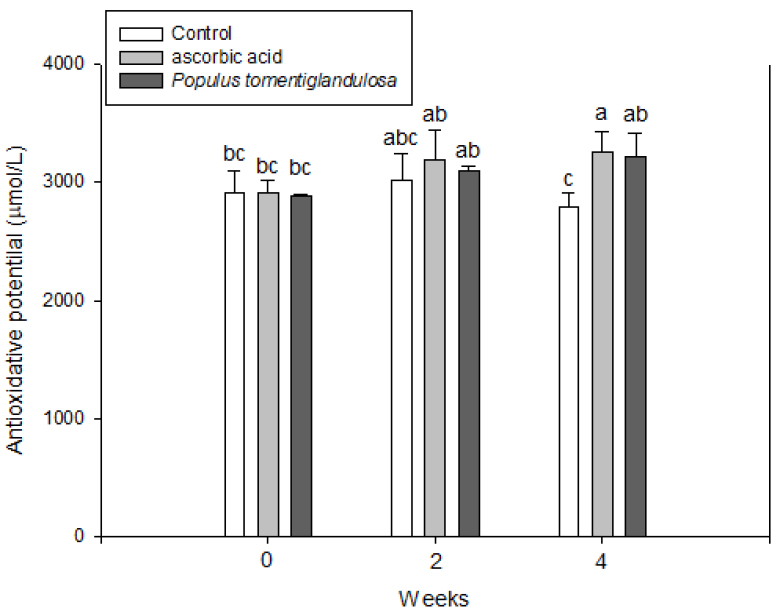
혈중 총 활성산소발생량 및 총 항산화능 변화
해당 식이로 4주 동안 사육하면서 측정한 혈중의 총 활성산소 발생량은 Fig. 1에 총 항산화능은 Fig. 2에 나타내었다. 실험 식이를 급여하기 전에 총 활성산소발생량을 측정한 결과 음성대조군과 양성대조군 및 현사시나무 추출물 급여군은 각각 182.0 ± 1.41, 192.0 ± 5.66 및 189.1 ± 4.28 U.Carr로서 통계적인 유의성은 보이지 않았다. 4주간 해당식이를 급여한 후 총 활성산소발생량을 측정한 결과 음성대조군과 양성대조군 및 현사시나무 추출물 급여군은 각각 179.3 ± 18.07, 151.8 ± 15.12 및 161.5 ± 31.83 U.Carr로서 양성대조군은 음성대조군에 비해 활성산소 발생량이 유의적으로 감소하였지만 현사시나무 추출물 급여군에서는 차이가 없었다. 음성대조군에 비해 활성산소 발생량이 감소하였지만 통계적인 유의적 차이는 나타나지 않았다. 실험 식이를 급여하기 전에 총 항산화능을 측정한 결과 음성대조군과 양성대조군 및 현사시나무 추출물 급여군은 각각 2908.3 ± 197.50 µmol/L, 2915.5 ± 96.87 µmol/L 및 2883.5 ± 20.51 µmol/L 로서 각 군간의 통계적인 유의성은 나타나지 않았으나 4주간 해당식이를 급여한 후 총 항산화능을 측정한 결과 음성대조군과 양성대조군 및 현사시나무 추출물 급여군은 각각 2787.8 ± 125.77 µmol/L, 3264.6 ± 170.34 µmol/L 및 3223.9 ± 200.60 µmol/L로서 음성대조군에 비해 양성대조군과 현사사시나무 추출물 급여군의 항산화능이 증가하는 것을 확인할 수 있었다. 혈중 총 활성산소 발생량의 경우 음성대조군에 비해 유의적인 차이는 없었으나 증가하는 경향을 보였고, 총 항산화능은 음성대조군에 비하여 유의적으로 높았으므로 현사시나무 70% 에탄올 추출물은 차후 항산화와 관련된 기능성 소재로서 이용가치가 높다고 사료된다.
요 약
본 연구에서는 현사시나무 70% 에탄올 추출물의 in vivo 항산화 효능검증을 위해 S.D계 웅성 rat에 AIN에서 권장한 식이조성에 현사시나무 70% 에탄올 추출물을 0.5%첨가한 식이를 4주간 급여한 후 2주 간격으로 혈중 총 활성산소발생량과 총 항산화능을 측정하였다. 그 결과, 식이섭취량과 식이효율 및 각종 장기 무게는 각 군간의 유의적인 차이를 보이지 않았으나 체중증가량은 음성대조군에 비해 양성대조군과 현사시나무 추출물 급여군이 유의적으로 높았다. 현사시나무 70% 에탄올 추출물의 급여군의 경우 음성대조군에 비해 통계적으로 유의하지는 않으나 혈중 총 활성산소발생량이 낮았고 총 항산화능은 음성대조군에 비해 유의적으로 높았다. 현사시나무 추출물은 항산화 효능이 우수하고 여러 가지 유용한 기능성 생리활성 성분을 함유하고 있어 앞으로 건강기능 소재로서 그 이용가치가 높다고 사료되고 향후 추출물 투여농도의 증가나 투여기간의 연장에 따른 추가적인 연구가 더 필요하다고 사료된다.