서 론
재료 및 방법
실험재료 및 시약
Platycoside E 및 platycodin D 분석
표준용액 및 시험용액의 조제
분석법의 유효성 검증
특이성
직선성
정밀성 및 정확성
검출한계 및 정량한계
결과 및 고찰
Platycoside E 및 platycodin D의 크로마토그램
특이성 확인
직선성 확인
정밀성 및 정확성
검출한계 및 정량한계
발효된 도라지 추출물의 platycoside E 및 platycodin D 함량 분석
요 약
서 론
도라지(Platycodon grandiflorum)는 초롱꽃과(campanulaceae) 식물로 한국, 중국 및 일본의 산간 지방에 널리 자생하며 주로 뿌리부분을 나물용 및 약용으로 사용하고 있다. 그중 나물용으로 사용되는 도라지는 주로 1-2년근을 사용하며, 약용 도라지는 3년근 이상의 도라지를 사용하고 있다(Kim et al., 2007; Lim, 1971; Sung and Seo, 1998). 도라지의 주된 효능으로는 혈당 강하(Seo et al., 2000), 콜레스테롤 대사 개선(Seo et al., 2000; Zhao et al., 2006), 항비만(Byen, 2003), 항염증(Choi et al., 2001), 면역 반응 증가(Choi et al., 2001), 항산화 효과(Jang et al., 2011; Kim et al., 1986), 아토피 피부염 개선(Kim et al., 2011; Kim et al., 2012) 등의 연구들이 보고되고 있다. 이러한 기능성을 가지는 도라지의 유효성분으로 도라지 뿌리에 함유되어있는 사포닌은 oleanane계 triterpene을 aglycone으로 하여 각 반응기에 하나 이상의 당을 결합하는 구조로 platycodin D와 polygalacin D, polygalacin acid 등을 포함하여 30여종 이상의 사포닌이 보고되어 있다. (Konish et al., 1978; Li et al., 2010; Tada et al., 1975). Yan 등(2012)의 연구에 따르면 한국 및 중국산 도라지의 사포닌 함량을 조사한 결과 platycoside E 와 platycodin D 함량이 가장 높은 것으로 나타났으며, Ha 등(2006)의 연구에 따르면 도라지에 함유된 사포닌 성분 중 platycoside E, platycodin D 및 polygalacin D가 높은 함량을 나타냈다. 따라서 발효된 도라지 추출물의 지표성분으로 pltycoside E와 platycodin D를 선정하였다.
최근 산업의 발달과 서구화된 식습관으로 인해 다양한 질병의 유병률이 증가함에 따라 건강식품에 대한 소비자의 니즈가 증가하고 있으며, 이에 따라 다양한 천연물을 소재로 한 건강기능식품이 개발되고 있다. 건강기능식품의 개발 및 생산을 위해서는 사용되는 원료의 표준화를 통해 기능성과 안정성을 입증해야 한다. 표준화는 일반적으로 지표성분의 표준화 방법을 사용하며, 원료부터 완제품을 생산하는 과정을 관리함으로써 천연물에 함유된 고유성분의 함량변화를 최소한으로 관리하여 품질을 일정하게 유지하는 것을 말한다. 천연물에 존재하는 지표성분에 대한 기준 및 규격을 설정하기 위해서는 공인된 분석방법 또는 정밀한 분석방법을 사용하여야 하며, 기준 규격의 설정을 위해 분석방법의 타당성 및 신뢰성이 검증되어야 한다(Choi et al., 2017; Kim et al., 2013). 따라서 본 연구에서는 발효된 도라지 추출물을 건강기능식품 원료로 개발 시 원료의 표준화를 위하여 platycoside E 및 platycodin D의 분석방법 및 분석법의 검증에 대한 연구를 실시하였다.
재료 및 방법
실험재료 및 시약
본 실험에서 사용한 도라지는 경상북도 영주에서 2017년에 재배한 것으로, 발효된 도라지 추출물은 (주)콤비메드(Yanggu, Korea)로부터 분말 형태로 제공받은 시료를 실험에 사용하였다. 표준물질 platycoside E, platycodin D는 AOBIOUS(AOBIOUS INC, Gloucester, MA, USA)에서 구입하였으며, HPLC 용매 acetonitrile은 J.T. Baker (Phillipsburg, NJ, USA)에서 구입하였다.
Platycoside E 및 platycodin D 분석
발효된 도라지에 함유된 platycoside E 및 platycodin D의 HPLC 분석은 Zhang et al. (2011)의 분석방법을 일부 변형하여 분석하였으며, 서로 다른 두 개의 표준물질을 동시분석 하였다. 실험에 사용된 HPLC는 Waters (Milford, Ma, USA)의 2695 Separation Module 및 996 Photodiode Array Detector를 사용하였다. HPLC with photodiode array detector에 사용된 분석용 컬럼은 Capcell Pak C18 MG (Shiseido, 4.6 × 250 mm, 5.0 µm, Tokyo, Japan)을 사용하였으며, Table 1의 분석조건으로 분석을 진행하였다.
Table 1.
HPLC conditions for sample analysis
표준용액 및 시험용액의 조제
Platycoside E 및 platycodin D 표준물질을 각각 10 mg 취하여 10 mL 정용플라스크를 이용해 1,000 µg/mL의 농도가 되도록 18% acetonitrile로 표선까지 정용하여 이를 stock solution으로 하였다. Working solution은 제조된 stock solution을 이용하여 0.78, 1.56, 3.13, 6.25, 12.5, 25, 50, 100, 200 µg/mL가 되도록 18% acetonitrile로 희석하여 사용하였다. 시험용액은 동결건조 된 시료를 40 mL 칭량한 후 10 mL 정용플라스크를 이용하여 4,000 µg/mL의 농도가 되도록 18% acetonitrile로 정용하고, 0.45 µm pore size PET syringe filter (Whatman, USA)으로 여과하여 시험용액으로 하였다.
분석법의 유효성 검증
분석법의 유효성 검증은 의약품 등 시험방법 밸리데이션 가이드라인(KFDA, 2015)을 근거로 하여 특이성(specificity), 직선성(linearity), 정밀성(precision), 정확성(accuracy) 및 검출한계(limits of detection, LOD), 정량한계(limits of quantification, LOQ)를 이용하여 분석법의 유효성을 검증하였다.
특이성
HPLC로 분석한 표준물질 platycoside E, platycodin D 및 발효된 도라지 추출물의 chromatogram을 비교하여 선택적으로 분리되는지 확인하였으며, PDA spectrum을 이용하여 동일한 specturm을 나타내는지 확인하였다.
직선성
Platycoside E 및 platycodin D 표준물질을 각각 0.78, 1.56, 3.13, 6.25, 12.5, 25, 50, 100, 200 µg/mL로 단계적으로 희석하여 3회 반복 측정하였으며, peak 면적에 대한 농도비로 작성한 검량선의 상관계수(correlation coefficient, R2) 값을 산출하여 직선성을 확인하였다.
정밀성 및 정확성
농도를 알고 있는 발효된 도라지 추출물에 표준용액 platycoside E 및 platycodin D의 1.5625, 12.5, 100 µg/mL 농도를 각각 첨가하였다. 정밀성 및 정확성에 대한 검증은 일간(inter-day)과 일내(intra-day)로 나누어 분석하였다. inter-day는 1일 1구간으로 3일간 분석하였고 inter-day는 1일 3구간으로 나누어 분석하였으며, 각 시험은 구간마다 3회씩 분석하였다. 분석하여 얻어진 peak 면적을 검량선을 이용하여 platycoside E와 platycodin D의 농도를 계산하였다. 정밀성은 상대표준편차(relative standard deviation, RSD%)을 통해 일간 및 일내 정밀성을 확인하였다. 정확성은 다음 식을 이용하여 회수율을 구해 정확성을 계산하였다.
Cf : Concentration of spiked sample
Cu : Concentration of sample
Ca : Concentration of standard solution
검출한계 및 정량한계
Platycoside E 및 platycodin D의 검출한계와 정량한계는 반응의 표준편차와 검량선의 기울기에 근거하여 다음 식을 이용하여 확인하였다.
σ: The standard deviation of the response
S : The slope of the calibration curve
결과 및 고찰
Platycoside E 및 platycodin D의 크로마토그램
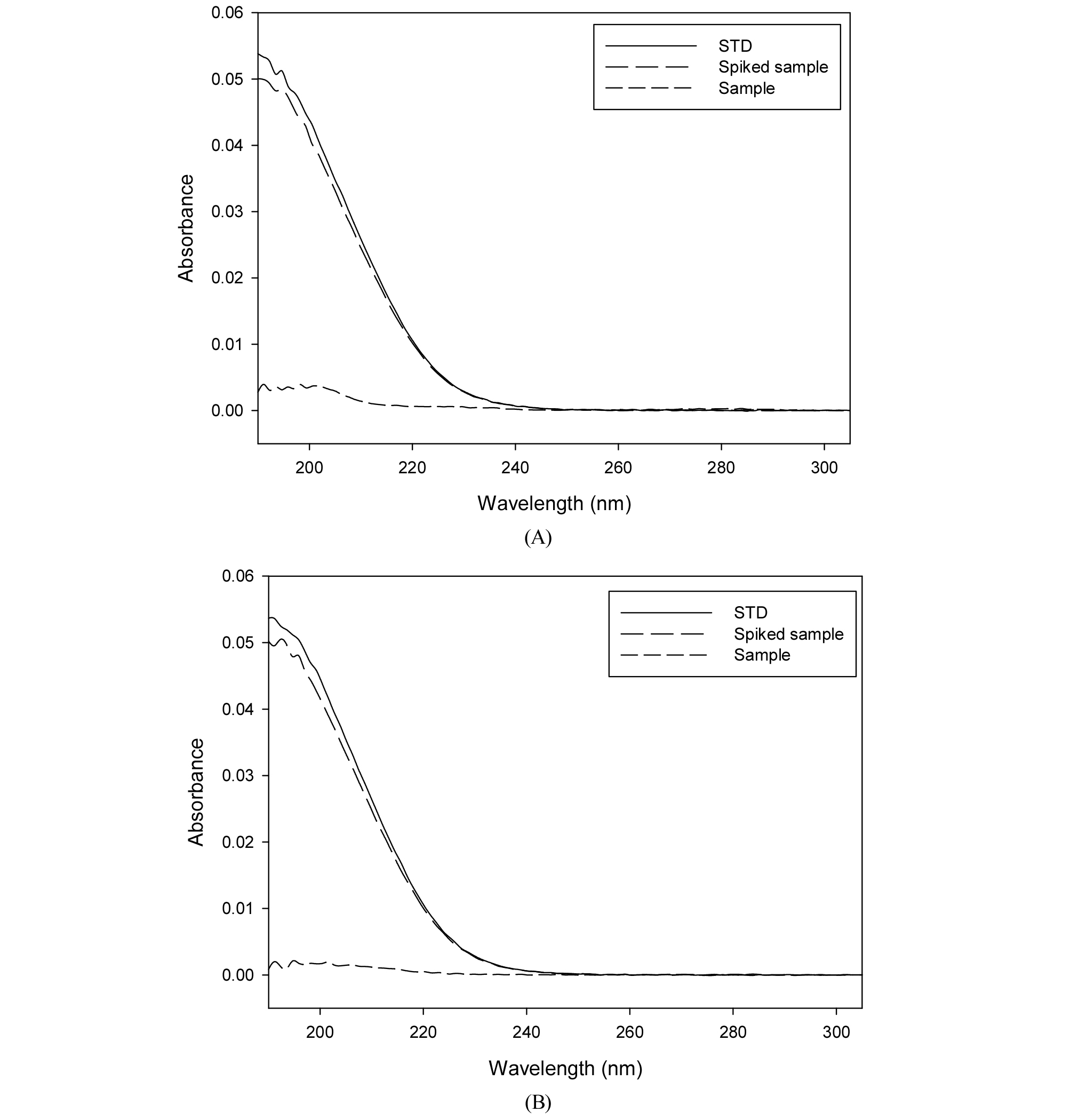
발효된 도라지 추출물에 함유된 지표성분을 구명하기 위하여 기존의 보고된 분석법을 재현한 결과, 분석시간이 길고 안정화 시간이 짧아 반복 측정시 기기의 안정화가 제대로 이루어지지 않아 재현성이 낮은 문제점을 보여 기기 조건을 일부 변형하여 최적 분석조건을 확립하였다(Table 1). 각 물질의 최대흡수파장인 190 nm와 기존의 보고된 논문의 분석 파장인 210 nm을 참고하여 최적 면적을 나타내는 파장 값인 210 nm로 최적분석파장을 설정하였다(Fig. 1).
특이성 확인
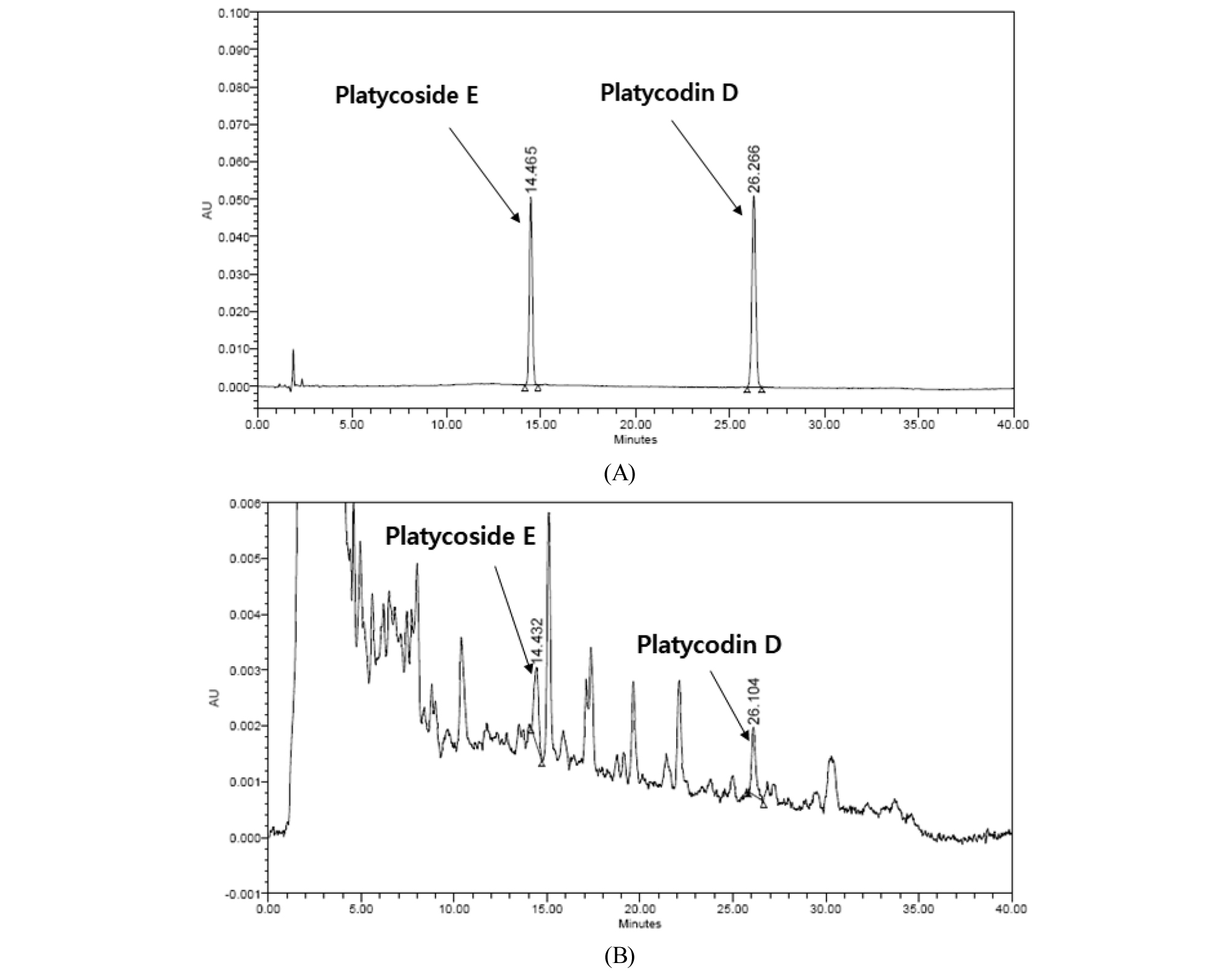
특이성은 불해물, 분순물, 배합성분 등의 혼재 상태에서 분석대상물질을 선택적으로 측정할 수 있는 능력을 말하며, 다른 물질의 간섭 없이 peak가 분리되는 것으로 특이성을 확인할 수 있다. 표준용액과 추출물의 chromatogram을 비교하여 platycoside E와 platycodin D의 peak를 확인한 결과 표준용액과 추출물의 retention time (RT) 값이 일치하였고, 표준용액의 경우 다른 성분들의 간섭 없이 분리되어 특이성을 확인하였으나 추출물의 경우 특이성이 부족한 것을 확인하였다. 검증된 분석법에 대한 신뢰성을 확보하고 물질에 대한 특이성을 검증하기 위하여 LC-MS/MS 분석을 통한 분석법의 재확인이 필요할 것으로 사료된다(Fig. 2).
직선성 확인
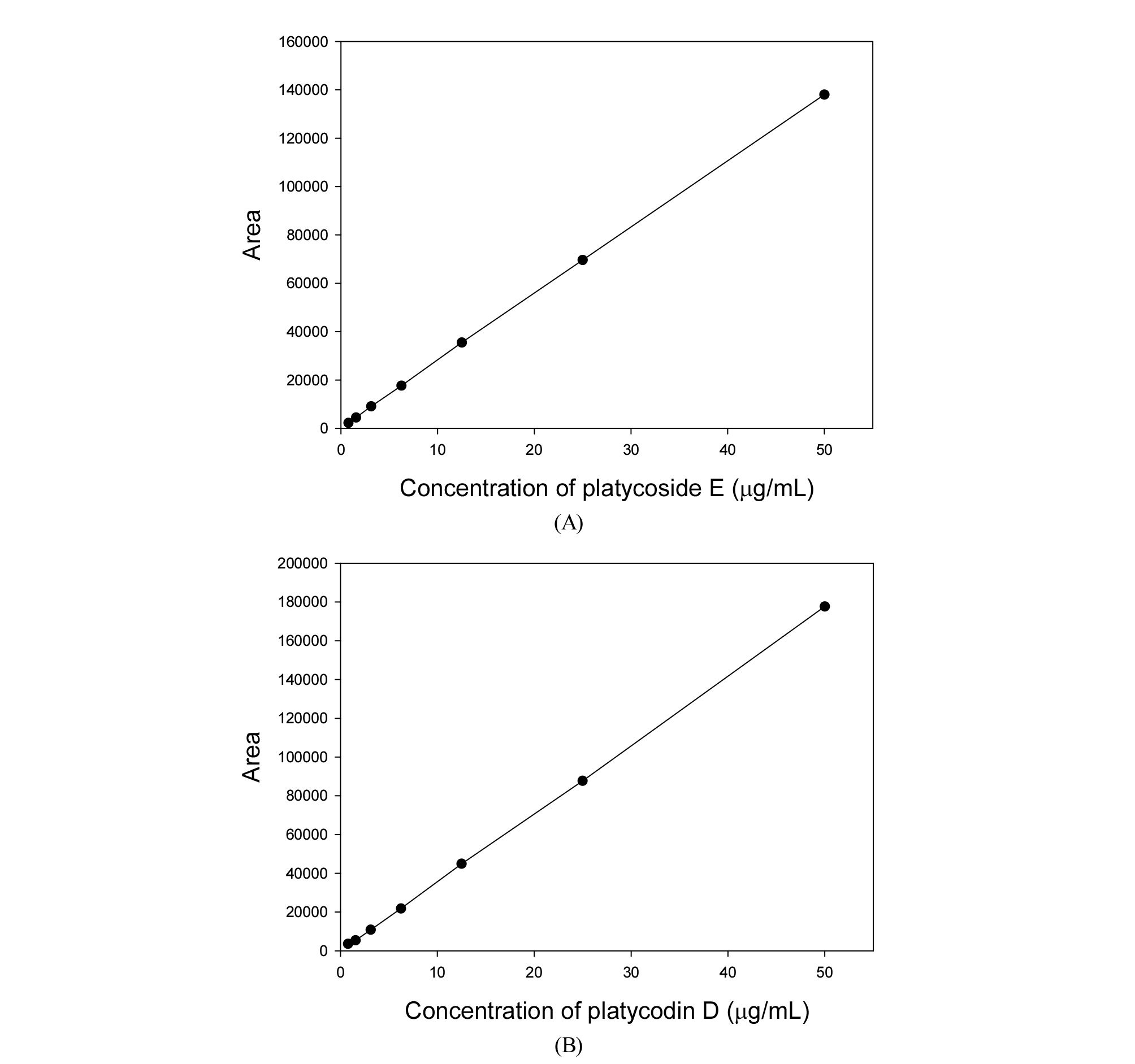
직선성은 시료 중 일정 범위 내에서 분석대상물질의 양에 비례하는 직선적인 측정값을 얻어낼 수 있는 능력을 말하며, 분석된 결과에 따라 y축을 peak 면적, x축을 표준용액의 농도(µg/mL)로 하여 작성된 calibration curve의 R2값으로 직선성을 확인하였다. Platycoside E 및 platycodin D 표준용액을 0.78, 1.56, 3.13, 6.25, 12.5, 25, 50, 100, 200 µg/mL 농도로 단계적으로 희석하여 HPLC로 분석한 결과 platycoside E 및 platycodin D의 표준검량선은 각각 y=2830.2x + 84.333, y=3545.5x + 23.544로 나타났으며 상관계수(R2) 값은 platycoside E 0.9999, platycodin D 0.9997을 나타내어 우수한 직선성을 보였다(Fig. 3).
정밀성 및 정확성
정밀성은 균일한 시료에 대하여 연속적인 분석을 통해 얻은 각각의 측정값들 사이의 근접성을 의미하며, 정확성은 측정값이 이미 알고 있는 참값이나 표준값에 근접한 정도를 의미한다. 농도를 알고 있는 발효된 도라지 추출물에 표준용액을 각각 저농도(1.5625 µg/mL), 중간농도(12.5 µg/mL), 고농도(100 µg/mL)로 첨가한 뒤 HPLC로 분석하였으며, 정밀성은 각 측정 결과 값의 분산정도를 확인하여 평가하였고 정확성은 회수율을 측정하여 평가하였다. 정밀성의 결과는 상대표준편차(RSD)로 확인하였으며 platycoside E 및 platycodin D의 정밀성은 일간 정밀성에서 각각 0.58-2.91%와 1.21-3.59%, 일내 정밀성에서 0.4-4.77%와 0.9-4.23%로 5% 이하의 우수한 정밀성을 나타내었다(Table 2).
정확성의 결과는 회수율을 측정하여 나타내었으며, Table 2와 같이 platycoside E 및 platycodin D의 일간 정확성은 94.81-110.62%, 94.02-115.73%, 일내 정확성은 94.63-104.35%, 94.11-122.82%로 우수한 정확성을 나타내었다.
Table 2.
Precision and accuracy of platycoside E and platycodin D analysis for fermented Platycodon grandiflorum root extract
검출한계 및 정량한계
검출한계는 주어진 신뢰 수준에서 검출 가능한 분석대상물질의 최소량을 말하며, 정량한계는 일정 수준의 신뢰성을 가지고 정량 분석할 수 있는 분석대상물질의 최소량을 의미한다. 검출한계와 정량한계를 분석한 결과 platycoside E 및 platycodin D의 검출한계는 각각 0.22 µg/mL, 0.31 µg/mL로 측정되었고, 정량한계는 0.68 µg/mL, 0.93 µg/mL로 측정되었다(Table 3). 이상의 결과를 종합하여 볼 때 발효된 도라지 추출물의 platycoside E 및 platycodin D는 HPLC를 이용한 동시분석과 정량분석이 가능한 것으로 나타났다.
Table 3.
Correlation coefficients of the calibration curves, limit of detection (LOD), and limit of quantification (LOQ) of platycoside E and platycodin D for fermented Platycodon grandiflorum root extract
발효된 도라지 추출물의 platycoside E 및 platycodin D 함량 분석
확립된 분석법을 이용하여 발효된 도라지 추출물 내 platycoside E 및 platycodin D의 함량을 분석한 결과는 Table 4와 같으며, platycoside E 2.20 ± 0.08 mg/dry weight g, platycodin D 1.29 ± 0.37 mg/dry weight g의 수준으로 함유되어 있는 것으로 분석되었다. 이상의 결과를 종합하여 볼 때 발효된 도라지 추출물의 platycoside E 및 platycodn D를 유용성분 및 지표성분으로 선정 시 분석법 검증을 통한 원료 표준화가 가능할 것으로 사료되며, 추출물 내 특이성을 보완하기 위해 HPLC-MS/MS 분석을 통한 추가 연구가 진행되어야 할 것으로 보인다.
요 약
본 연구에서는 HPLC를 이용하여 발효된 도라지의 platycoside E 및 platycodin D의 분석법 검증을 실시하였다. 분석법은 특이성, 직선성, 정확성, 정밀성, 검출한계 및 정량한계를 통하여 신뢰성을 검증하였다. HPLC를 이용한 분석방법에서 표준용액과 발효된 도라지 추출물의 머무름 시간이 일치하는 것을 확인하였다. 표준물질의 peak는 다른 성분의 간섭 없이 선택적으로 분리되는 것을 확인하였으나, 추출물의 경우 peak가 다른 성분의 간섭에 의해 특이성이 감소하는 것으로 나타났다. Platycoside E 및 platycodin D의 검량선은 상관계수 값이 각각 0.9999, 0.9997로 나타나 우수한 직선성을 나타내어 분석에 적합함을 확인하였다. Platycoside E 및 platycodin D의 정밀성은 일간 정밀성과 일내 정밀성으로 확인하였으며, platycoside E 및 platycodin D의 일간 정밀성에서 각각 0.58-2.91%, 1.21-3.59%를 나타내었으며 일내 정밀성에서는 0.40-4.77%, 0.9-4.23%로 5% 이하의 값을 나타내어 우수한 정밀성을 보였다. 정확성 측정 결과 platycoside E 및 platycodin D의 일간 정확성은 각각 94.81-110.62%, 94.02-115.73%를 나타내었으며, 일내 정확성은 94.63-104.35%, 94.11-122.82%로 우수한 정확성을 나타내었다. Platycoside E 및 platycodin D의 검출한계는 각각 0.22 µg/mL, 0.31 µg/mL로 측정되었고, 정량한계는 0.68 µg/mL, 0.93 µg/mL로 나타나 저농도에서도 검출이 가능함을 확인하였다. 발효된 추출물 시료 중 platycoside E 및 platycodin D의 함량을 분석한 결과 platycoside E 2.20 ± 0.08 mg/dry weight g, platycodin D 1.29 ± 0.37 mg/dry weight g의 함량을 가지고 있는 것으로 분석되었다. 분석법 검증 결과, 확립된 분석법은 직선성, 정밀성, 정확성, 검출한계 및 정량한계가 우수한 분석법임을 검증하였으나, 분석법의 특이성을 보완하고 검증된 분석법의 신뢰성을 확보하기 위하여 추후 LC-MS/MS 분석을 통한 추가 실험이 필요할 것으로 사료된다.