서 론
최근 식품시장은 건강 증진과 질병 예방에 기여하는 기능성 식품에 대한 수요 및 연구개발이 지속적으로 증가하고 있으며(Lee, 2013; Eaves, 2016), 항비만, 혈압억제, 항당뇨, 항산화 등 대사질환과 건강한 노화에 관련된 연구가 활발하게 진행되고 있다(Bae, 2013; Lee, 2014; Jeong, 2010; Kim, 2016). 당알콜은 당류의 알데히드 또는 케톤기가 알콜기로 치환된 물질로서 만니톨(mannitol), 솔비톨(sorbitol), 아라비톨(arabitol), 자일리톨(xylitol) 등이 있으며, 저칼로리 탄수화물 소재로서 소화 대사과정 중에 인슐린을 요구하지 않는 대표적인 기능성 식품소재이다(Park, 2016; Lawson, 2007; Mechri, 2015).
만니톨은 육탄당의 당알콜로 다양한 채소, 해조류, 과일 등에 존재하며, 당뇨병 환자를 위한 대체 감미료로 사용된다(Song, 2009; Kim, 2016). GRAS (Generally Recognized Asa Safe)로 승인 된 만니톨은 식품, 제약 산업 등에 매우 광범위하게 활용되고 있으며, Raney nickel을 촉매제로 포도당과 과당의 수소화 반응을 통하여 생산되고 있다(Baer, 1988; Mishra, 2013). 그러나 사용된 과당의 약 30%만 만니톨로 전환되고, 나머지 70%는 솔비톨로 전환되어 순도가 높은 만니톨을 생산하는데 어려움이 있다(Song and Vieille, 2009). 또한 최근 소비자의 인공 합성 물질에 대한 기피 현상과 천연 원료에 대한 선호도 증가에 따라 미생물 발효를 통한 만니톨 생산기술은 화학적 생산방법의 대안으로 연구되고 있다(Park et al., 2016; Otgonbayar, 2011).
만니톨 생산 균주로는 Zycosaccharomyces rouxii (Grolean, 1995), Leuconostoc citreum (Otgonbayar et al., 2011), Leu. mesenteroides (Kim, 2002), Lactobacillus intermedius (Saha, 2003) 등이 있으며, 만니톨의 생산은 주로 이형 발효 젖산균인 Leuconostoc 속, Oenococcus 속, Lactobacillus 속 등의 미생물을 사용한다(Song and Vieille, 2009; Wisselink, 2002, Korakli, 2003). Leuconostoc 속은 주로 우유, 포도 그리고 다양한 채소류에 주로 분포하며 우유와 채소류 발효를 위한 스타터 균주로 이용되고 있다(Wisselink, 2002; Jung, 2012). 세포 내에서 만니톨 생산은 산화환원 준위를 유지하기 위해 과당이 mannitol dehydrogenase (MDH) 효소에 의해 환원되는 반응으로 탈수소화 시켜 생성한다(Saha and Nakamura, 2003; Grobben, 2001; Aarnikunnas, 2002). 또한, 세포 내로 유입된 과당은 fructokinase 효소에 의해 fructose 6-phosphate로 전환되어 phosphoketolase 경로를 통해 균체의 성장에 이용되며(Burge, 2015), Leu. mesenteroides 균주의 경우, 과당이 과량으로 존재하는 경우 MDH에 의하여 대부분의 과당이 전자 수용체 역할을 하여 만니톨이 생성되는 것으로 보고된 바 있다(Vandamme, 1987). 또한, 이 (Lee, 2013) 등은 fructokinase 유전자의 화학적 돌연변이를 이용하여 만니톨 생산능이 향상된 균주를 선발할 수 있는 기술을 보고하였다.
본 연구에서는 전통 발효식품인 김치로부터 분리된 젖산균의 만니톨 생산능을 탐색하여 만니톨 생산성이 우수한 Leu. mesenteroides KCTC13305 균주를 선발하였다. 과당의 농도, 과당과 포도당의 혼합 비율, 배양 온도 등이 균주의 성장과 만니톨 생산에 미치는 영향을 조사하여 만니톨 대량생산을 위한 기초자료를 확보하였다.
재료 및 방법
균주 및 배양조건
한국식품연구원(Korea Food Research Institute, KFRI, Korea) 및 한국생명공학연구원 미생물자원센터(Korean Collection for Type Cultures, KCTC, Korea)로 부터 다양한 김치에서 분리된 51점의 젖산균을 분양 받았다. 균주는 20 g/L의 포도당이 첨가된 MRS (BD Diagnostic Systems, USA) 배지에 접종하여 30°C로 유지되는 진탕배양기(Hanbaek Scientific Co., Korea)에서 10시간 동안 배양한 뒤, 600 nm에서 세포흡광도(OD600)를 측정하고 적정량의 세포를 회수하였다. 회수한 세포는 멸균 증류수로 2회 세척한 후 20 g/L의 과당(Sigma-Aldrich, USA)이 첨가된 MRS 배지에 세포흡광도가 0.1이 되도록 접종하였다. 진탕배양기를 이용하여 30°C에서 세포흡광도가 1이 될 때까지 배양한 후 상등액을 회수하여 과당과 만니톨의 농도를 측정하였다.
만니톨 생산을 위한 기질로서 포도당과 과당을 사용하였으며, 초기 농도 100 g/L를 기준으로 포도당과 과당을 다양한 비율로 첨가한 MRS 배지를 사용하였다. 만니톨 생산을 위한 최적의 과당 농도를 결정하기 위해서 MRS 배지에 과당을 다양한 농도로 첨가하여 사용하였다. 삼투압이 만니톨 생산에 미치는 영향을 조사하기 위하여 NaCl을 배지에 첨가하였고, 완충용액을 사용하여 pH를 조절한 배지와 배양온도를 조절하여 만니톨 생산에 미치는 영향도 조사하였다.
발효기(Biostat® B plus, Sartorius, Germany)에서 선발 균주의 만니톨 생산은 교반속도 500 rpm, 통기속도 1 vvm 조건에서 시험하였다. 완충용액을 이용하여 pH를 6으로 조절하고 100 g/L의 과당을 함유한 MRS 배지를 사용하여 48시간 동안 배양하였다.
분석방법
균체성장은 흡광광도계(Ultrospec 6300 pro, GE Healthcare, Sweden)를 사용하여, 세포흡광도를 측정하여 결정하였다. 만니톨, 과당 및 포도당 농도는 Rezex RPM-Monosaccharide Pb++ (Phenomenex, USA)컬럼이 장착된 HPLC (Shimadzu, Japan)를 사용하여 측정하였으며 이동상으로서 증류수를 0.6 mL/min의 유속으로 사용하였다. 상업적으로 판매하는 표준물질을 적정농도로 희석하여 검량선을 작성하였다.
통계처리
모든 측정은 3회 수행하였으며 평균값과 표준오차는 SPSS (v 22.0, SPSS, USA)를 이용하여 결정하였으며, Duncan’s multiple range test (Duncan, 1955)를 통하여 유의성을 검증하였다.
결과 및 고찰
균주 선발
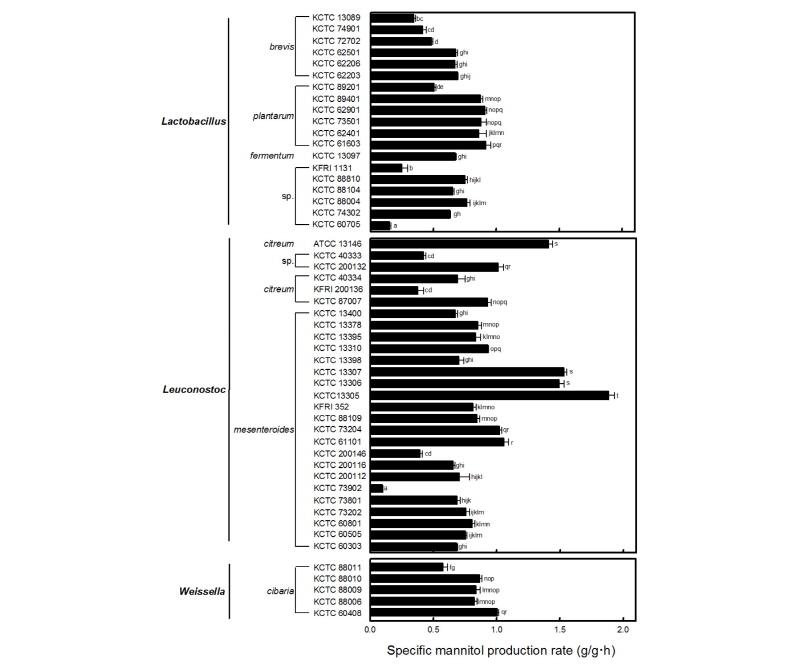
김치에서 분리된 Lactobacillus 속, Leuconostoc 속 및 Weissella 속 등 51점의 젖산균을 이용하여 20 g/L의 과당을 함유한 MRS배지에서 만니톨 생산성을 측정하였다(Fig. 1). Lactobacillus 속 균주 중에서 L. plantarum 균주들의 만니톨 생산성이 상대적으로 우수한 것으로 나타났으며, 그 중에서도 배추김치에서 분리된 L. plantarum KCTC61603 균주가 0.92 ± 0.08 g/L ․ h로 가장 우수한 만니톨 비생산성(specific production rate)을 나타냈다. Weissella 속 젖산균 중에서는 W. cibaria KCTC60408 균주가 1.01 ± 0.02 g/L ․ h로 가장 우수한 만니톨 생산성을 나타냈으나, Leu. mesenteroides KCTC13305 균주의 만니톨 생산성의 약 52% 수준이었다. Leuconostoc 속 균주 중에서는 배추김치에서 분리된 Leu. mesenteroides KCTC13305 균주가 1.89 ± 0.09 g/L ․ h로 우수한 만니톨 생산성을 나타냈으며, Leu. mesenteroides KCTC73902 균주는 51점의 젖산균 중에서 가장 낮은 만니톨 생산성을 나타냈다. 따라서, 본 연구에서 사용한 51점의 젖산균 중에서 Leu. mesenteroides KCTC13305 균주를 만니톨 생산이 우수한 균주로 선발하였다.
배양조건이 만니톨 생산에 미치는 영향
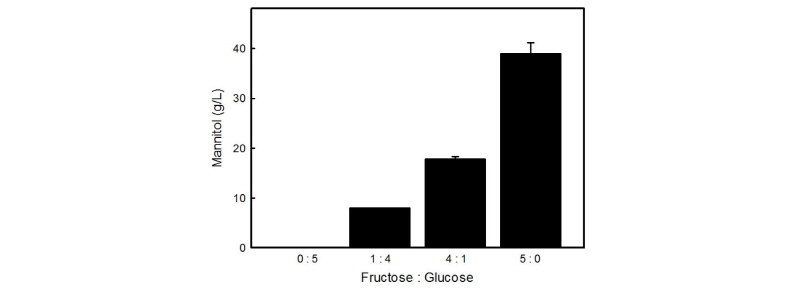
초기 농도 100 g/L를 기준으로 과당과 포도당의 혼합비율을 달리하여 제조한 MRS 배지를 이용하여 Leu. mesenteroides KCTC13305 균주의 만니톨 생산량을 측정하였다(Fig. 2). 만니톨 생산을 위한 탄소원으로서 포도당만 단독으로 첨가한 배지에서는 만니톨이 생산되지 않아, Leu. mesenteroides KCTC13305 균주는 포도당을 이용하여 만니톨을 생산하지 않는 것으로 판단하였으며, 과당의 비율이 증가할수록 만니톨 생산량이 증가하는 경향을 나타냈다. 과당을 100 g/L 농도로 첨가한 배지에서 Leu. mesenteroides KCTC13305 균주는 39.03 ± 3.71 g/L의 만니톨을 생산하여, 31.5 g/L의 만니톨을 생산하는 것으로 보고된 Leu. mesenteroides sp. JFY 균주 (Yoo, 2005)보다 상대적으로 우수한 생산량을 나타냈다.
과당을 다양한 농도로 첨가한 MRS 배지를 사용하여 Leu. mesenteroides KCTC13305 균주의 만니톨 생산량, 수율 및 생산성을 조사하였다(Fig. 3). 과당을 10 g/L로 첨가한 MRS 배지에서 균체는 성장하였으나 만니톨은 생산되지 않았다. 과당이 100 g/L 수준으로 첨가된 배지에서 L. mesenteroides KCTC13305 균주는 39.0 ± 3.7 g/L의 만니톨을 생산하여 소모한 과당을 기준으로 70.6%의 만니톨 생산수율을 나타냈으며, 이는 윤(Yun, 1996) 등이 보고한 Lactobacillus sp. KY-107 균주의 만니톨 생산수율(70%)과 유사한 수준이었다. 또한, Leuconostoc sp. KY-002 균주(Ryu, 1996)와 Leu. intermedius NRRL B-3693 균주(Saha and Nakamura, 2003)는 과당의 초기 농도가 높을수록 만니톨의 생산량과 생산성이 감소하는 것으로 나타났으며, Leu. mesenteroides KCTC13305 균주도 150 g/L와 250 g/L의 과당을 함유한 배지에서 각각 35.5 ± 5.9, 31.6 ± 2.3 g/L의 만니톨을 생산하며 유사한 경향을 나타냈다. 만니톨 생산성은 150 g/L의 과당을 첨가한 배지에서 0.40 ± 0.07 g/L ․ h로 가장 우수한 것으로 나타났으나 100 g/L의 과당을 함유한 경우에 비하여 약 20% 낮게 나타나 과당 농도 100 g/L를 Leu. mesenteroides KCTC13305 균주의 최적 과당농도로 결정하였다.
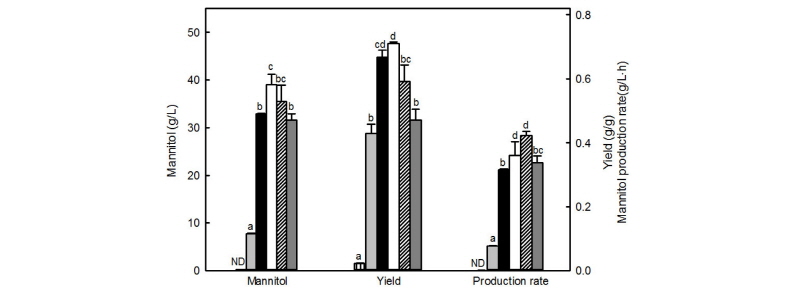
Fig. 3. Effects of initial fructose concentration on mannitol production by Leuconostoc mesenteroides KCTC13305 grown in MRS at 30°C for 48 h. Black, 1%; light grey, 2%; dark grey, 5%; white, 10%; light black, 15%; grey, 25%; ND: not detected. Means and standard errors from three independent cultures are shown. Different letters in each experimental group indicate significant differences between means.
배양온도, 배지의 초기 pH, NaCl의 첨가가 Leu. mesenteroides KCTC13305 균주의 성장과 만니톨 생산에 미치는 영향을 조사하였다(Fig. 4). 실험조건으로 설정한 모든 온도 범위에서 초기에 약 4시간 정도의 유도기를 거쳐 12시간까지 대수기로 성장하였으며, 48시간동안 배양한 결과 25°C에서 최대 균체성장을 나타내었다. 과당의 소모량은 80 g 내외로 25°C를 제외한 모든 온도 조건에서 유의적인 차이를 나타내지 않았다(Fig. 4A). 만니톨 생산량은 온도가 높아짐에 따라 감소하는 경향을 나타냈으며, 최대 균체성장을 나타내었던 25°C에서 가장 높은 만니톨 생산량을 나타내었다. 김치로부터 분리한 Leu. citreum KACC 91348P 균주는 최적 배양 온도가 30°C로 나타났으며(Otgonbayar et al., 2011), L. brevis, L. fermentum 등의 균주(Weymarn, 2002)는 35°C에서 만니톨의 생산이 가장 우수한 것으로 보고되었다. 기존에 보고된 젖산균은 최적 생육온도가 30-35°C가 대부분이었으나, Leu. mesenteroides KCTC13305 균주는 상대적으로 낮은 온도에서 생육 적온을 나타내었다.
Leu. mesenteroides KCTC13305 균주의 만니톨 생산에 대한 배지의 pH의 영향을 알아보기 위하여 pH 4-8의 범위로 조정한 MRS 배지에서 48시간 동안 배양하였다(Fig. 4B). 초기 배지의 pH가 4로 조정된 배지에서는 만니톨이 생산되지 않았으며, 과당의 소모량도 15.3 ± 2.6 g/L로 다른 pH의 배지보다 상대적으로 낮게 나타났다. Leu. mesenteroides KCTC13305 균주는 초기 pH가 6으로 조정된 배지에서 83.7 ± 0.7 g/L의 과당을 소모하여 61.6 ± 0.3 g/L의 만니톨을 생산하였다. 만니톨을 생산하는 Leuconostoc sp. KY-002 (Ryu et al., 1996)와 Lactobacillus sp. KY-107 (Yun et al., 1996) 균주도 최적 pH가 6으로 보고되었다.
NaCl의 첨가에 대한 Leu. mesenteroides KCTC13305 균주의 생육 특성을 조사하기 위하여 0-2%의 NaCl을 첨가한 배지에서 48시간 동안 배양하였다(Fig. 4C). NaCl을 0.5% 농도로 첨가한 배지에서는 만니톨의 생산이 대조구와 비슷한 수준으로 나타났으나, NaCl 농도가 증가할수록 만니톨 생산량과 과당의 소모량은 감소하였다.
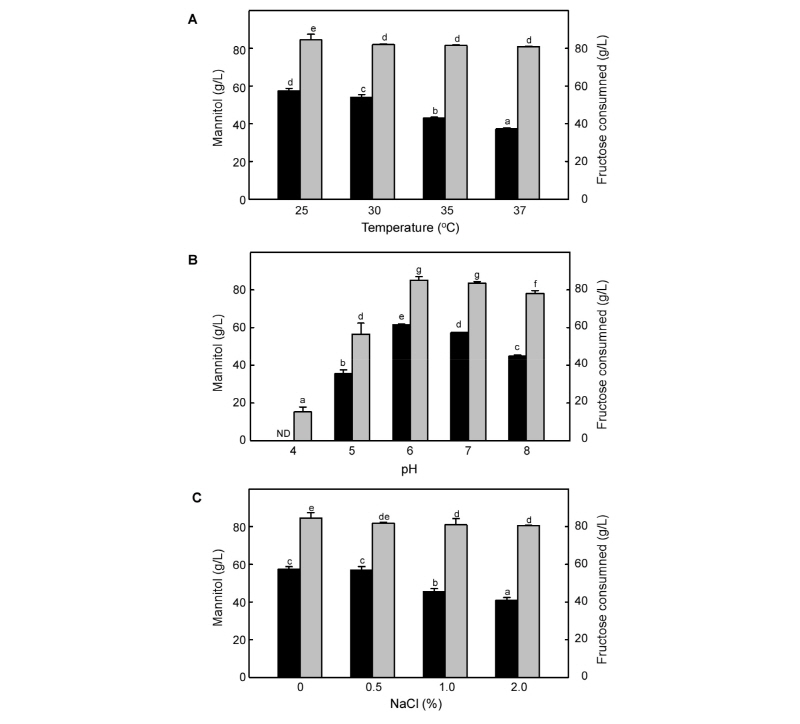
Fig. 4. Effects of cultivation temperature (A), pH (B), and NaCl concentration (C) on mannitol production by Leuconostoc mesenteroides KCTC13305. ND: not detected. Means and standard errors from three independent cultures are shown. Different letters in each panel indicate significant differences between means.
Leu. mesenteroides KCTC13305 균주는 산도가 pH 6으로 조정된 배지를 사용하여 25°C에서 배양할 때 가장 우수한 만니톨을 생산하는 것으로 나타났으며, 0.5% 이하의 NaCl은 만니톨 생산에 영향을 미치지 않는 것으로 나타났다.
발효기를 이용한 만니톨 생산
초기 배지의 pH를 6으로 조정하고 과당을 100 g/L로 첨가한 3L의 MRS 배지에 Leu. mesenteroides KCTC13305 균주를 접종하여 25°C에서 48시간 동안 배양하였다(Fig. 5). 배양 15시간 이후 균체의 성장은 정체기를 나타냈으나, 과당은 균체의 성장과 함께 꾸준히 소모되어 44시간 이후에는 10 g/L 이하로 나타냈다. 만니톨은 배양 3시간 후부터 생산되어 15시간 이후에는 정체되는 경향을 나타냈으며, 48시간 후에는 56.9 ± 0.7 g/L를 생산하였다. 기존에 보고된 Leu. Mesenteroides sp. Strain JFY 균주는 만니톨 생산 조건의 최적화를 통해서 배양 조건을 설정하였을 때, 31.5 g/L의 만니톨을 생산하였으며(Yoo et al., 2005), Leu. mesenteroides KCTC13305 균주는 약 1.8배의 만니톨 생산량을 나타냈다. 젖산은 40시간 동안 꾸준히 생산량이 증가하였으며, 40시간 이후에는 정체되는 경향을 나타냈으며, 48시간 후에는 10.0 ± 0.1 g/L를 생산하였다. Leu. mesenteroides KCTC13305 균주와 기존에 보고된 Leu. mesenteroides NRRL B-1149균주(Kim et al., 2002)는 100 g/L의 과당을 함유한 배지에서 각각 62.1%, 59.6%의 만니톨 생산수율을 나타냈으며, 본 연구를 통해 선발한 Leu. mesenteroides KCTC13305 균주의 만니톨 생산수율이 더 우수하였다.
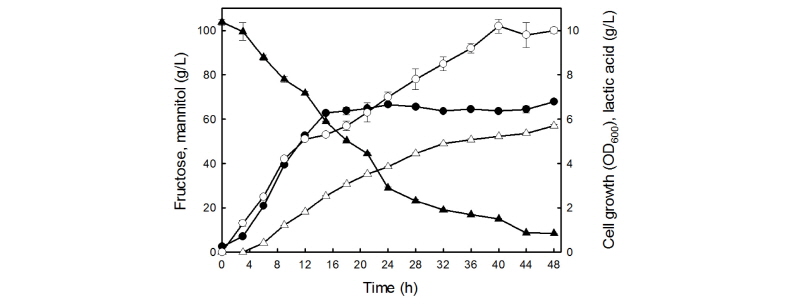
Fig. 5. Batch fermentation profiles of Leuconostoc mesenteroides KCTC13305 cultivated in 3 L-scale jar fermenter maintained at pH 6 and 25°C. Agitation rate and aeration were 300 rpm and 1 vvm, respectively, throughout the cultivation. Data represent cell growth (OD600, ●), fructose (▲), mannitol (△), and lactic acid (○). Means and standard errors from three independent cultures are shown.
본 연구를 통하여 김치에서 분리한 Leu. mesenteroides KCTC13305 균주의 우수한 만니톨 생산성을 확인하였으며, 만니톨의 산업적 생산을 위한 균주 개량 등의 추가적인 연구가 필요할 것으로 판단된다.