서 론
재료 및 방법
곰팡이 포자 현탁액 준비
파프리카 살균 및 포자 현탁액 접종
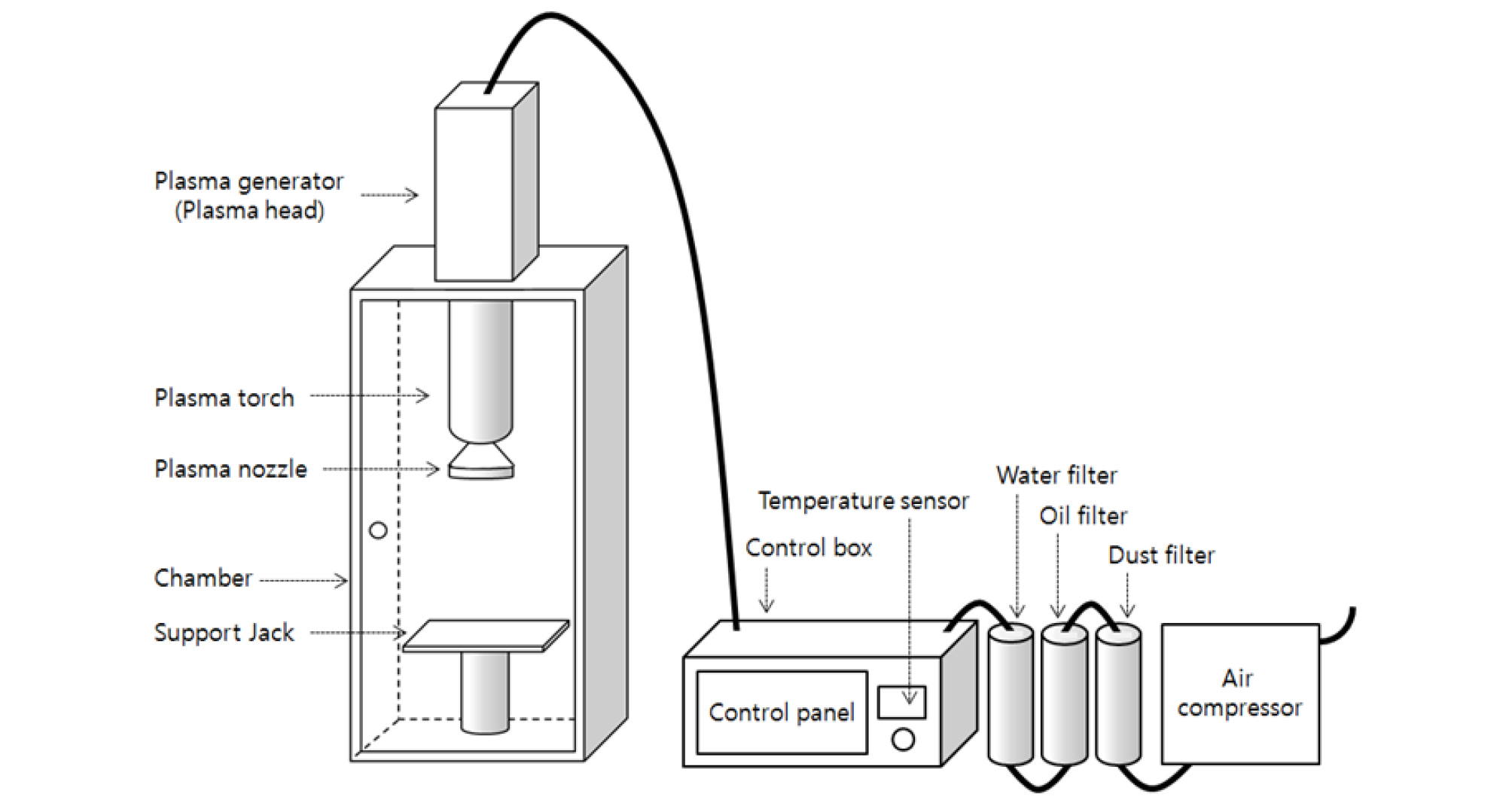
저온 대기압 플라즈마 처리
곰팡이 생장 억제율 in vitro 평가
파프리카 접종 곰팡이 생장 억제율 in vivo 평가
파프리카 색도 및 경도 평가
통계처리
결과 및 고찰
저온 대기압 플라즈마 처리에 의한 A. alternata와 B. cinerea의 in vitro 억제 효과
저온 대기압 플라즈마 처리에 의한 파프리카에서의 A. alternata와 B. cinerea의 in vivo 생장 억제 효과
저온 대기압 플라즈마 처리한 파프리카의 색도 및 경도 평가
서 론
파프리카는 식품으로부터 유래한 천연착색제로써 널리 사용되며, 동시에 capsanthin 및 zeaxanthin 등 카로티노이드계 색소의 훌륭한 급원이다(Matsufuji, 1998). 파프리카는 국내에서 지난 수년 동안 농업 산업에서 빼놓을 수 없는 신선 농산물 수출의 주요 작물로써, 그 생산량이 꾸준히 상승하고 있다. 그에 따라, 곰팡이 등으로 인한 파프리카의 수확 후 품질 저하 현상은 관련 산업에서 치명적인 경제적 손실을 일으켜 최근 심각한 문제로 대두되고 있다(Cha et al., 2007). Botrytis cinerea가 유발하는 잿빛 곰팡이병은 우리나라 파프리카 수출단지 및 선과장에서 가장 문제가 되고 있는 병해로 보고된 바 있다(Kim et al., 2013). 전 세계적으로 수확 후 곰팡이병 제어에 관한 여러 연구들은 화학적 처리에 관한 연구가 대부분인 실정이다. 그러나, 에틸렌 옥사이드(ethylene oxide)와 같은 화학적 살진균제들은 과일 및 채소의 향, 맛 또는 중량 손실을 일으키는 것으로 알려져 있다. 또한 살진균제는 곰팡이 내성 발달 및 건강과 환경에 관한 대중들의 관심 증가로 지속적 사용이 제한적인 실정이다(Fernandez et al., 2009; Hong et al., 2007; Vajdi and Pereira, 1973; Williamson et al., 2007).
저온 대기압 플라즈마(non-thermal atmospheric plasma, NTAP)는 수확 후에 영향을 주는 병원균 제어에 활용하고 있다. 이 기술은 실온에 가까운 저온으로도 병원균 제어에 효과적이며, 그 외에도 다양한 분야에서 실용적으로 활용 가능한 대체 기술이다(Khamsen et al., 2016; Siddique et al., 2018). 저온 대기압 플라즈마는 고전압으로 인해 공기를 이온화시켜 이온, 자유전자, 자유라디칼 및 여러 활성종의 화합물뿐만 아니라, UV, 오존 등의 하전 입자들을 생성한다(Lacombe et al., 2015; Laroussi and Leipold, 2003; Niemira, 2012). 이러한 활성종들이 미생물의 세포막 및 세포 내부 물질의 손상을 초래함으로써 병원균을 사멸시키는 역할을 한다(Kim et al., 2017; Lee et al., 2015; Niemira, 2012). 진균이 플라즈마에 노출되면 이러한 활성종들에 의해 생리적 기능을 마비시키는 화학적 및 대사적 변화가 일어난다.
따라서 본 연구에서는 저온 대기압 플라즈마가 파프리카의 저장성에 영향을 주는 B. cinerea와 파프리카 선과장에서 순수 분리한 A. alternata의 제어 효과를 in vitro 및 in vivo 평가를 통해 검증하고자 하였다.
재료 및 방법
곰팡이 포자 현탁액 준비
본 연구에서는 농촌진흥청 농업미생물은행(Wanju, Korea)으로부터 분양받은 잿빛 곰팡이병을 유발하는 Botrytis cinerea (B. cinerea, KACC 40573)와 수출 파프리카 선과장의 파프리카 과실에서 순수 분리한 검은 곰팡이(A. alternata)에 대하여 다양한 조건으로 대기압 플라즈마 처리한 후 살균효과를 확인하였다. 곰팡이 배양 배지는 PDA (Potato Dextrose Agar, BD company, USA)를 사용하였다. 0.1% Tween 80 (AMRESCO, USA) 3-5 mL을 곰팡이가 충분히 자란 petri dish에 넣고 cell scraper를 이용하여 긁어모은 포자 현탁액을 멸균거즈로 걸러 conical tube에 모았다. 포자 현탁액 농도는 hemocytometer로 측정하여 7.0 log CFU/mL로 사용하였다.
파프리카 살균 및 포자 현탁액 접종
(주)조은그린(Cheorwon, Korea)에서 구입한 수출용 파프리카를 1% 락스에 2분간 침지하여 살균한 뒤 증류수로 세척하고 clean bench에서 자연건조하여 준비하였다. 살균한 파프리카의 표면을 멸균한 팁으로 살짝 상처를 낸 후에 곰팡이 포자 현탁액 1 × 107 conidia/mL을 10 µL 접종하고 clean bench에서 10분 휴지시킨 후 대기압 플라즈마 처리하였다.
저온 대기압 플라즈마 처리
본 연구에서는 Fig. 1과 같은 (재)철원플라즈마산업기술연구원 내의 저온 대기압 플라즈마 발생시스템을 이용하였다. 처리조건은 전력 1 kW, 기압 2.5 bar, 노즐로부터의 거리(30 cm), 처리시간(10-90 sec.)의 다양한 범위에서 수행하였다. 대기압 플라즈마 처리한 곰팡이의 생장 억제율을 평가하기 위해 지름 60 mm petri dish의 가운데에 곰팡이 포자 현탁액 20 µL 떨어뜨린 후 저온 대기압 플라즈마 처리하였다. 곰팡이 포자 현탁액을 접종한 파프리카는 30, 60 sec 처리하였다.
곰팡이 생장 억제율 in vitro 평가
PDA배지 상에서 저온 대기압 플라즈마 처리한 곰팡이 포자는 균사체의 충분한 생장을 위해 28°C incubator에서 3일간 배양하였다. 생장 억제율(%) = {1[(플라즈마 처리한 곰팡이 colony 지름)-(무처리 곰팡이 colony 지름)]}×100으로 제시하였다.
파프리카 접종 곰팡이 생장 억제율 in vivo 평가
곰팡이 포자 현탁액 접종 후 저온 대기압 플라즈마 처리한 파프리카는 200 × 130 × 50 cm 크기의 플라스틱 박스에 넣어 상대습도 95%의 조건으로 실온(25°C)에 10일간 저장하였다. 파프리카 접종 곰팡이의 지름을 측정하여, 생장 억제율(%) = {1[(플라즈마 처리한 파프리카 곰팡이 colony 지름)-(무처리 파프리카 곰팡이 colony 지름)]}×100으로 제시하였다.
파프리카 색도 및 경도 평가
저온 대기압 플라즈마 처리하고 7일간 냉장(4 ± 3°C)저장한 파프리카의 겉 표면을 색차계(Chroma Meter, CM-5, Minolta Co., Japan)를 이용하여 hole size에 맞게 시료를 올려놓고 Hunter’s color system에 의한 명도(lightness, L*), 적색도(redness, a*) 및 황색도(yellowness, b*)를 측정하였다. 또한 경도 측정을 위해 처리한 파프리카를 25.0 mm의 정사각형 크기로 절단하여 사용하였다. Texture analyzer (TA-XY2i, Stable Micro System Co., Surrey, UK)를 사용하여 파프리카의 hardness를 측정하였다. 분석조건은 pre-test speed 5.0 mm/s, test speed 2.0 mm/s, post-test speed 1.0 mm/s, distance 10.0 mm, load cell 5 kg의 조건으로 cylinder type aluminium probe (2 mm diameter)를 장착하여 상온에서 측정하였다.
통계처리
모든 실험은 3회 반복 수행하였으며, 모든 측정값은 평균 ± 표준편차로 나타내었다. 통계처리는 SPSS 13.0 for Windows (SPSS, Inc., Chicago, IL, USA)를 사용하여 분석하였고, Duncan’s multiple range test와 independent samples t-test를 통해 유의성을 검정하였다.
결과 및 고찰
저온 대기압 플라즈마 처리에 의한 A. alternata와 B. cinerea의 in vitro 억제 효과
파프리카를 수확 후 저장할 때 잿빛 곰팡이병을 유발하는 B. cinerea와 파프리카 선과장에서 순수 분리한 검은 곰팡이(A. alternata)에 대하여 저온 대기압 플라즈마 처리 후, 배지 상에서 나타나는 제어 효과를 조사했다. 곰팡이포자에 플라즈마 처리 후 28°C incubator에서 3일간 배양하고 측정한 군락의 지름으로부터 처리시간에 따른 inhibition ratio (%)로 나타냈다(Fig. 2). 저온 대기압 플라즈마 처리시간이 0초에서 90초로 증가할수록 A. alternata의 생장이 유의적으로 저해되었으며, 그 효과는 90초에서 최대(100%)로 나타났다(Fig. 2A, 2B). B. cinerea 또한 A. alternata와 같은 결과를 나타냈다. 즉, 플라즈마를 더 오래 처리할수록 곰팡이 생장 억제율은 유의적으로 증가하여, 90초 처리 시 100% 억제 효과를 나타냈다(Fig. 2C, 2D). 본 결과는 벼키다리병을 유발하는 병원균인 Gibberella fujikuori가 플라즈마 처리에 의해 영양배지에서의 생장이 효과적으로 억제되어 120초 처리 시 92% 생장 억제율을 나타냈다는 선행연구 결과와 일치한다(Jo et al., 2014). 여러 연구들에 의하면, 미생물에 플라즈마 기술을 적용했을 때, 세포막이 손상되어 삼투압 균형이 깨지고 세포내액 및 영양성분들이 용출되어, 최종적으로 세포 사멸의 결과를 초래한다고 보고되었다(Joshi et al., 2011; Lunov et al., 2014; Siddique et al., 2018). 또한, 플라즈마 처리 시 접촉한 산소 및 질소는 여러 활성종들로 분해되는데, 이 때 유도된 활성종들이 미생물 세포막의 손상을 일으키는 것으로 알려져 있다(Lu et al., 2014; Song et al., 2009; Xiong et al., 2010).
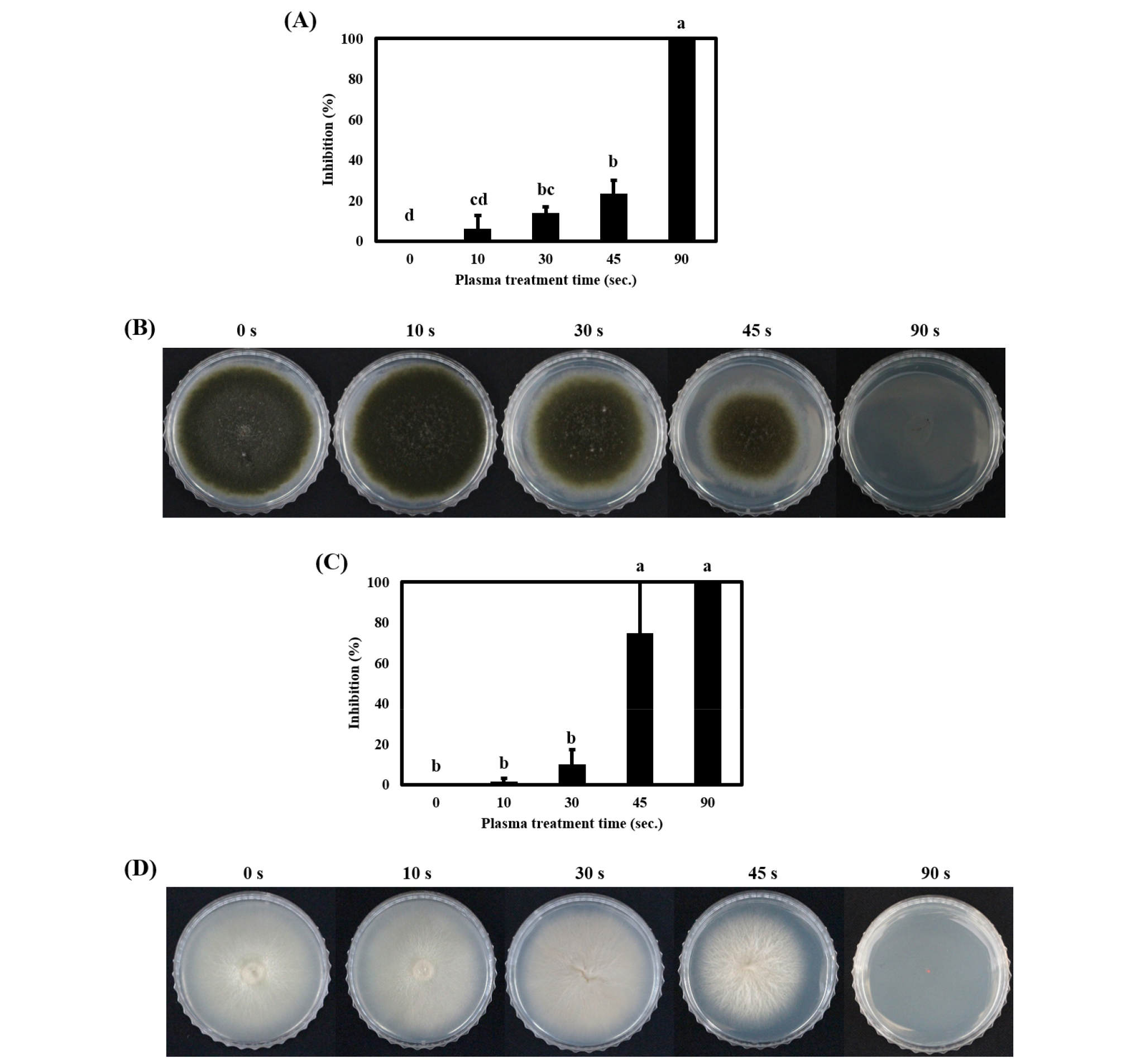
Fig. 2.
Inhibitory effect of non-thermal atmospheric plasma treatment on the spores of A. alternata and B. cinerea. (A) The inhibitory effect of plasma treatment on the spores of A. alternata. (B) The effect of plasma treatment on the spores of A. alternata on medium. (C) The inhibitory effect of plasma treatment on the spores of B. cinerea. (D) The effect of plasma treatment on the spores of B. cinerea on PDA medium. The vertical bars represent standard deviation. The values represented with different superscript letters are significantly different (P < 0.05).
저온 대기압 플라즈마 처리에 의한 파프리카에서의 A. alternata와 B. cinerea의 in vivo 생장 억제 효과
In vitro 실험을 통해 저온 대기압 플라즈마 처리가 A. alternata 및 B. cinerea의 사멸을 유도함을 확인하여, 플라즈마에 의한 파프리카에서 A. alternata 및 B. cinerea의 생장 억제 효과를 확인하고자 하였다. 살균한 파프리카에 곰팡이 2종의 포자 현탁액을 각각 접종하고 저온 대기압 플라즈마 처리 후 실온(22 ± 3°C) 조건에서 10일간 저장했을 때 나타난 사멸효과를 처리시간에 따른 검은 곰팡이병 병징 또는 잿빛 곰팡이병 병징의 크기(diameter, mm) spot diameter (mm)로 나타냈다(Fig. 3). 대기압 플라즈마 처리 시간이 증가할수록 접종한 A. alternata에 의해 파프리카 과실 표면에 생긴 검은 곰팡이병의 크기는 유의적으로 감소했다. 30초 처리 시 약 25% 억제되었고, 90초 처리 시 증식 억제 효과는 약 55%로, 가장 높았다(Fig. 3A, 3B). B. cinerea의 결과도 유사하게 나타났다. 즉, 플라즈마 처리 시간이 증가하면서 접종한 B. cinerea에 의해 파프리카 과실 표면에 생긴 잿빛 곰팡이병의 크기가 감소하여, 90초 처리 시 무처리군에 비해 약 20% 증식 억제 효과를 나타냈는데(Fig. 3C, 3D), 유의차는 나타나지 않았다(P > 0.05). 본 연구 결과는 플라즈마 처리 시간이 증가할수록 양파 파우더의 Bacillus cereus spore 및 육류의 식품유래 병원균들이 효과적으로 불활성화 되었다는 선행연구들의 결과와 일치했다(Jayasena et al., 2015; Kim et al., 2017). 따라서, 저온 플라즈마 처리는 in vitro 및 in vivo 실험에서 저장성 병원균인 A. alternata 및 B. cinerea를 시간 의존적으로 최소 25%에서 최대 100% 사멸시키는 것으로 나타나, 파프리카의 저장성 병원균을 효과적으로 억제하기 위해 저온 대기압 플라즈마 시스템을 적용 가능할 것으로 사료된다.
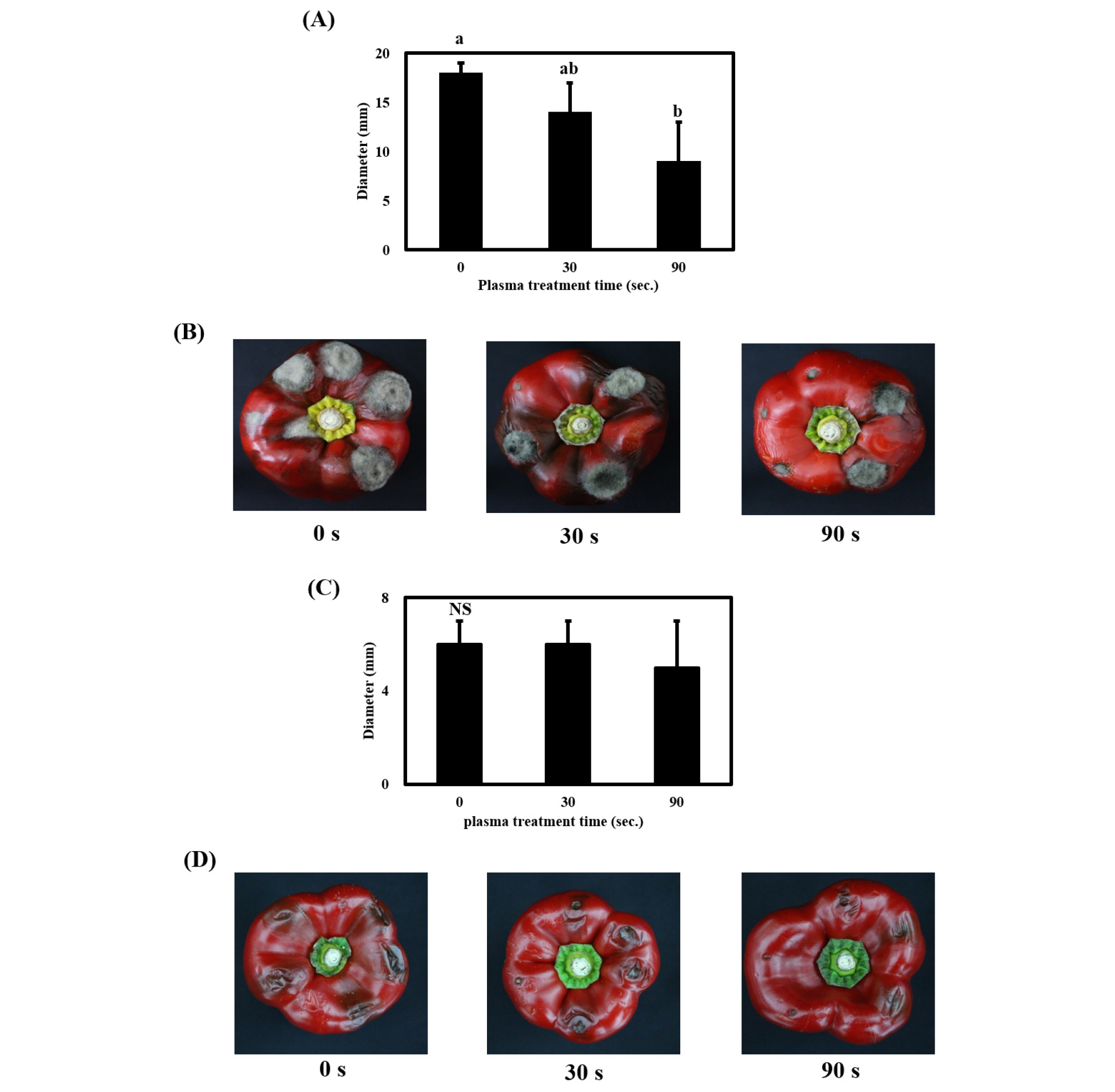
Fig. 3.
In vivo experiment for the effect of non-thermal atmospheric plasma treatment on A. alternata and B. cinerea inoculated on paprika. (A) Diameter (mm) of the spores of A. alternata inoculated on paprika. (B) Symptoms of A. alternata on paprika treated with plasma for the indicated time. (C) Diameter (mm) of the spores of B. cinerea inoculated on paprika. (D) Symptoms of B. cinerea on paprika treated with plasma for the indicated time. The vertical bars indicate standard deviation. The values represented with different superscript letters are significantly different (P < 0.05). NS: not-significantly different.
저온 대기압 플라즈마 처리한 파프리카의 색도 및 경도 평가
저온 대기압 플라즈마 처리로 인해 소비자의 기호도에 영향을 주는 품질적 변화를 평가하기 위해, 파프리카를 플라즈마 처리하고 7일간 냉장(4 ± 3°C)저장한 후 색도 및 경도를 측정하여 비교한 결과를 Table 1에 나타냈다. 색도 parameter로써, 명도(L*), 적색도(a*) 및 황색도(b*)를 측정한 결과, 명도는 60초 처리 샘플을 제외하고, 0, 30, 및 90초 처리 샘플은 유의차가 나타나지 않았다(P > 0.05). 적색도의 경우, 0, 60초 처리했을 때는 차이가 없고(P > 0.05), 30, 90초 처리했을 때는 7일 후 다소 높아졌다. 황색도는 30초 샘플을 제외하고, 0, 60, 및 90초 처리 했을 때 유의차가 나타나지 않았다(P > 0.05). 비록 몇몇 샘플에서 통계학적으로 유의한 차이를 보였지만, 플라즈마 처리 후 냉장저장 전과 후의 표면 색 차이는 시각적으로 구분하기는 어려운 미세한 정도였다. 본 연구결과는 여러 채소 및 과일에 대하여 플라즈마 처리한 후 색도를 측정했을 때, 목측 관찰을 통한 색 변화는 유의한 차이를 보이지 않았으나, 통계학적으로는 유의한 결과가 나타난 선행연구 결과와 일치하였다(Bermúdez-Aguirre et al., 2013; Wang et al., 2012). 따라서, 플라즈마 처리에 의한 색도 변화는 소비자 선호도에 영향을 주지 않을 것으로 판단했다. 한편, 경도는 플라즈마 처리 후 7일간의 냉장 저장 후에도 플라즈마 처리 유무와 상관없이 유의적인 차이가 나타나지 않았다(P > 0.05). 본 연구결과와 일치하는, 저온 플라즈마 처리가 제품의 품질에 무해하다고 주장하는 몇 연구들과 달리, 반대의 연구결과들 또한 보고되었다(Lacombe et al., 2015; Thirumdas et al., 2015). 즉, 20분 또는 그 이상의 장시간 플라즈마 처리가 신선 식품 외피의 색, 향미 또는 경도에 영향을 미쳐 저장성 병원균의 제어 효율을 떨어뜨린다고 보고하였다. 결론적으로, 본 연구를 통해 저온 대기압 플라즈마 기술은 파프리카에 검은 곰팡이병을 유발하는 A. alternata와 잿빛 곰팡이병을 유발하는 B. cinerea의 제어에 효과적이며, 동시에 파프리카의 색도 및 경도 품질에 미치는 영향은 무시할 수 있을 것으로 사료된다.
Table 1. Color and texture of paprika fruits during 7 days of refrigerated storage at 4°C after plasma treatment for the indicated time