서 론
김치는 우리나라 고유의 대표적인 발효식품으로 배추와 무 등의 채소류와 마늘, 고춧가루 등의 부재료를 사용하여 만들며, 다양한 미생물이 발효 과정에 관여한다(Chang et al., 2011). 김치 발효에 관여하는 미생물로는 Weissella koreensis 균주(Lee and Lee, 2011), 내산성이 우수한 Leuconostoc mesenteroides 균주(Jang et al., 2016), Lactobacillus citreum 균주(Lee et al., 2013) 등이 있다. 그 중에서도 Leu. mesenteroides 균주는 산업적으로 가장 많이 활용되고 있는 발효 미생물 중 하나이며, 전통 쌀 발효 음료(Jeong et al., 2011), 김치 발효 스타터(Yi et al., 2016), 대두 발효용 종균(Oh and In, 2008) 등으로 사용되고 있다.
미생물 또는 효소를 이용하여 전구물질로부터 목적하는 물질을 생산하는 생물전환(Boconversion)은 미생물 또는 효소의 기질 특이성을 이용하여 구조적 변화를 통한 함량, 흡수율 증가 등의 생물학적인 변화를 유도하는 기술이다(Diener et al., 2009). 표고버섯 균사에 의한 대두의 생물전환을 통하여 비배당체 이소플라본의 함량을 증가시킨 연구가 보고되었으며(Jung et al., 2016), 인삼 사포닌 가공과 관련하여 식용 미생물을 이용한 생물전환 기술에 대한 연구도 활발히 진행되고 있다(Yi et al., 2012; Shim et al., 2014).
콩잎은 보편적으로 채취하여 섭취하는 식품 원료는 아니지만, 경상도 지역에서 콩잎 김치, 물김치 등으로 섭취하는 별미 음식 중의 하나이다(Lee et al., 1995). 따라서 대부분의 콩잎은 콩을 수확하기 위한 부수적인 생산물로 인식되고 있으며, 관련 가공제품도 거의 전무한 상태이다. 소금 농도가 콩잎 김치의 숙성에 미치는 영향(Lee et al., 2003b), 키토산 첨가에 의한 콩잎 김치의 저장성 향상 연구(Lee et al., 2003a), 콩잎 분말을 첨가한 두부 개발(Kim et al., 2011) 등 콩잎을 이용한 관련 식품의 품질을 개선하는 것이 대부분이다. 콩잎에 함유된 생리활성 성분으로는 이소플라본류, 플라본류, 페놀성 화합물, 플라보놀류 등이 보고되었으며, Ho 등(Ho et al., 2002)은 콩잎에 캠퍼롤 배당체가 존재하는 것을 보고하였다. 따라서 유용 생리활성 물질들이 풍부하지만 관련 제품의 개발이 미흡한 콩잎을 원료로 사용하여 고부가 식품 소재 및 제품을 개발하기 위한 기반연구가 필요하다.
이소플라본은 자연계의 식물에서 발견되는 식물성 에스트로겐(phytoestrogen)으로 여성호르몬인 에스트로겐과 유사한 생리활성을 나타내며, 장내미생물 균총에 의해 생리활성을 나타낸다(Vitale et al., 2013). 그러나 이소플라본은 식품 중 대부분 배당체 형태로 존재하여 체내 흡수율이 낮은 단점이 있으며, 이를 개선하기 위하여 비배당체(aglycone) 형태로 전환하는 기술이 필요하다(King et al., 1996; Kim et al., 2010). 배당체의 당쇄결합을 가수분해하는 효소들은 분해하는 당의 종류에 따라서 다양한 종류가 존재하며, 젖산균에서 β-xylosidase (Jang and Kim, 2011), β-glucuronidase (Kim et al., 2019), β-glucosidase (Shim et al., 2014) 등의 효소활성이 보고되었다.
β-Glucosidase (EC 3.2.1.21)는 β-1,4 당쇄 결합을 가지고 있는 기질로부터 포도당을 유리시키는 효소로서, 다양한 기질에 작용하여 식품, 세제, 화학 등 여러 산업 분야에서 활용되고 있으며(Ahmed et al., 2017), 생산성이 우수한 균주를 확보하기 위한 연구가 지속적으로 수행되고 있다(Cho and Han, 2015). 된장에서 분리된 Leu. mesenteroides YLB8 균주는 우수한 β-glucosidase 효소활성이 보고되었으며, 이를 이용하여 배당체 형태의 진세노사이드(ginsenoside) Rb1과 Rb2를 비배당체 형태의 진세노사이드인 Rg3로 전환하는 것으로 알려졌으며(Shim et al., 2014), 김치에서 분리된 젖산균 중에서 β-glucosidase 효소활성이 우수한 Weissella cibaria KFRI88010 균주가 분리되었다(Jang and Kim, 2010).
대두의 이소플라본은 대부분 배당체의 형태로 존재하며(Lee et al., 2002), 이들의 생체 흡수율을 높이기 위하여 비배당체 형태로 생물전환(King et al., 1996)하는 다양한 방법이 연구되었다(Axelson and Setchell, 1981). 칡 추출물에 함유된 이소플라본을 Pediococcus pentosaceus 균주를 이용하여 dihydrodaidzein으로 생물전환한 연구가 보고되었으며(Lee et al., 2013), Lactobacillus plantarum과 Bifidobacterium longum 균주를 이용하여 대두의 이소플라본을 비배당체로 전환한 연구가 수행되었다(Kim et al., 2010).
본 연구에서는 전통 발효 식품인 김치로부터 β-glucosidase 효소활성이 우수한 Leu. mesenteroides 균주를 분리하고 콩잎 추출물에 함유된 이소플라본 비배당체 생산효율을 조사하였다.
재료 및 방법
김치로부터 젖산균을 분리하기 위하여 강원도 춘천에서 제조한 배추김치 2점과 홍천, 횡성에서 제조한 배추김치 각 1점을 수집하였다. 수집한 시료를 생리식염수(0.85% NaCl)에 희석하여 MRS (BD, UK) 평판배지에 도말하고 30°C에서 24시간 동안 배양하였다. 생성된 단일 집락을 5 mL의 MRS 배지에 접종하여 30°C에서 24시간 동안 배양한 후 저온냉동고(-80°C)에 보관하였다.
분리한 균주 중 β-glucosidase 효소활성을 보유한 균주를 선별하기 위하여 1.5%의 bromocresol purple (BD)이 함유된 MRS 평판배지를 이용하여 30°C에서 24시간 동안 배양한 후, 오렌지 색 환을 생성하는 미생물을 선발하였다. 선발한 균주를 5 mL의 MRS 배지에 접종하고 30°C에서 24시간 동안 배양한 후 β-glucosidase 효소활성을 측정하였다(Jang and Kim, 2011). 배양액을 9,000 × g에서 10분간 원심분리하고 상등액을 회수하여 조효소액으로 사용하였다. 검량선은 p-nitrophenol 용액(Sigma, USA)을 적정 농도로 희석하여 작성하였고, 검량선을 이용하여 생성된 p- nitrophenol의 농도를 결정하였다. 효소활성은 30°C에서 1분 동안 1 µmole의 p-nitrophenol을 생성하는 효소의 양을 1 unit으로 정의하였다.
선발된 균주의 효소활성 특성을 확인하기위해 탄소원으로 cellobiose (Sigma)가 첨가된 MRS 배지를 이용하였다. 초기 세포 흡광도(OD600)가 0.1이 되도록 접종한 후 35°C에서 8시간 배양하였으며, 배양액을 원심분리하여 상등액을 회수하였다. 효소 반응 온도를 25, 30, 37, 40, 45°C로 설정하였으며, pH는 완충액(pH 5.0, sodium acetate/acetic acid; pH 6.0, 6.8, 7.0, 8.0, potassium phosphate)을 사용하여 조정하였다. 대조구 균주로는 Leu. mesenteroides KCTC13388를 사용하였다.
선발된 균주를 동정하기 위하여 염색체 DNA을 추출한 후, 27F (5'-AGAGTTTGATCATGGCTCAG-3')와 1492R (5'-GGATACCTTGTTACGACTT-3') primer (Hong et al., 2009)를 사용하여 16S ribosomal RNA 유전자 영역을 증폭하였다. 증폭된 유전자의 염기서열은 National Center for Biotechnology Information (NCBI)의 BLAST (Altschul et al., 1990) 방법을 이용하여 다른 균주와의 상동성을 기반으로 동정하였다. 계통수 분석은 maximum likelihood method (Tamura and Nei, 1993)를 이용하여 MEGA7 (7.0.26, USA)(Kumar et al., 2016) 프로그램으로 분석하였다.
균주의 탄소원 대사 특성은 API 50 CHL kit (BioMerieux Ltd, FR)를 사용하여 조사하였다.
콩잎은 강원도 농업기술원에서 제공받은 호반 품종을 사용하였으며, 흐르는 물에 3회 세척한 후 30°C에서 24시간 건조하였다. 건조된 콩잎은 250°C에서 5분 동안 덖은 후 10분 동안 유념하였으며, 덖음과 유념 과정을 3회 반복하였다. 전처리가 완료된 콩잎은 물을 용매로 사용하여 90°C에서 12시간동안 추출하였다(Yoon et al., 2019).
단일집락 균주를 MRS 배지에 접종하여 35°C에서 24시간 진탕 배양한 후 원심분리하여 세포를 회수하였다. 회수한 세포는 멸균 증류수로 2회 세척하고 콩잎 추출물에 세포 흡광도가 1.0이 되도록 접종하여 35°C에서 48시간 배양하였다.
이소플라본 배당체 2종(Daidzin, Genistin)과 비배당체 2종(Daidzein, Genistein)을 지표물질(Sigma)로 선정하고, LiChrospher RP-18컬럼(SUPELCO, USA)이 장착된 HPLC (Shimadzu, Japan)를 사용하였다. 이동상은 A: Water/ acetic acid (99.9:0.1)와 B: Acetonitrile/acetic acid (99.9:0.1)을 사용하여 1.0 mL/min의 유속으로 흘려주었으며, 자외선 검출기로 254 nm에서 측정하였다(Lee et al., 2005).
모든 측정은 3회 반복하였으며, SPSS Statistics (v22, IBM, USA)를 사용하여 Duncan의 다중범위 검정방법(Duncan, 1955)으로 유의성을 검정하였다.
결과 및 고찰
강원도 지역에서 수집한 김치로부터 총 112점의 젖산균을 분리하여 β-glucosidase 효소활성을 조사하였다(Fig. 1). 확보한 균주 중 49점의 젖산균에서 세포외의 β-glucosidase 효소활성이 나타났으며, 그중에서도 MSL129 균주가 0.026 ± 0.002 U/mg protein으로 가장 우수한 활성을 나타냈다. 배추김치에서 분리한 MSL19와 MSL170 균주가 각각 0.017 ± 0.001 U/mg protein, 0.016 ± 0.001 U/mg protein의 β-glucosidase 효소활성을 나타냈다.
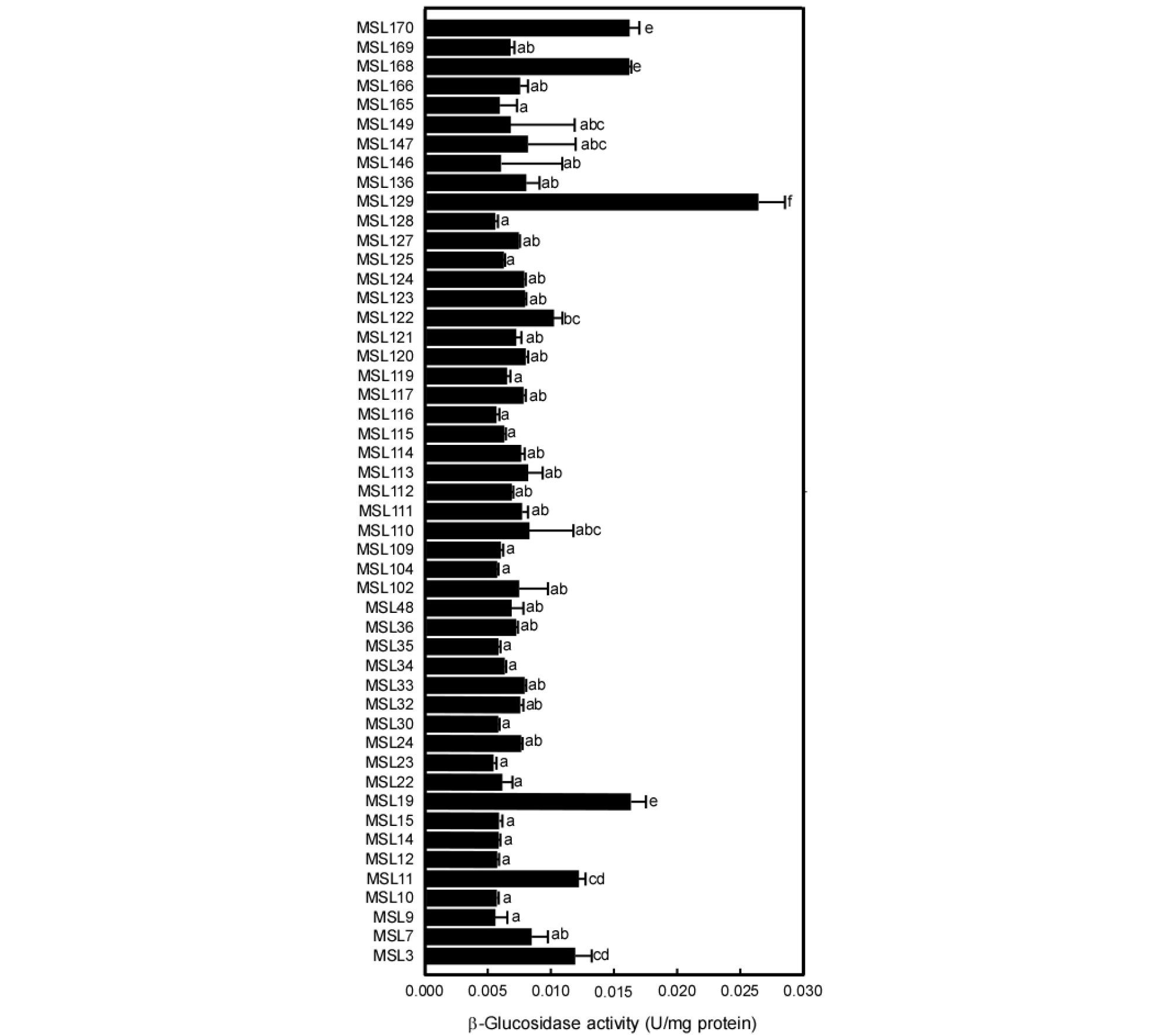
Fig. 1.
Comparison of β-glucosidase activity levels of lactic acid bacteria isolated from Kimchi. Glucose was used as a carbon source and incubated at 30°C for 24 h. Averages and standard errors were determined from three independent measurements are shown. Different letters indicate significant differences between averages.
Jang 등(Jang and Kim, 2010)의 연구에서 김치에서 분리한 젖산균 중에서 가장 우수한 β-glucosidase 효소활성을 나타낸 균주로 W. cibaria KFRI88010 균주가 선발되었으며, 과당이 탄소원으로 사용되었을 때 가장 높은 효소활성을 나타냈다. 다양한 천연물의 비배당체화를 위하여 전통식품에서 분리한 젖산균의 β-glucosidase 효소활성에 대한 연구가 진행되고 있으며, 된장에서 분리된 Leu. mesenteroides YLB8 균주를 활용한 팽화홍삼의 진세노사이드 비배당체화에 관한 연구가 보고되었다(Shim et al., 2014).
가장 우수한 β-glucosidase 효소활성을 나타낸 MSL129 균주의 16S rRNA 유전자 염기서열을 분석하였다. 김치에서 분리된 MSL129 균주는 Leu. mesenteroides (MH844904)와 98.9%의 상동성을 나타내어(Table 1) Leu. mesenteroides MSL129 균주로 명명하였으며, 한국생물자원센터(KCTC)에 기탁하였다(KCTC13578BP). 젖산균 중 β-glucosidase 효소활성이 우수한 균주로는 김치로부터 분리된 Lac. rhamnosus GG (Ku et al., 2016), W. cibaria (Lee et al., 2012) 등이 보고되었으며, 누에콩에서 분리한 Pediococcus pentosaceus 균주(0.028 ± 0.002 U) (Verni et al., 2017)는 Leu. mesenteroides MSL129 균주의 β-glucosidase 효소활성과 유사하였다.
Table 1. Percent identity (upper right) and the number of different nucleotides (lower left) of Leu. mesenteroides MSL129 and other lactic acid bacteria
Leu. mesenteroides MSL129 균주와 다양한 젖산균의 16S rRNA 유전자 염기서열을 비교한 결과(Table 1) Leu. citreum과 90.6%의 상동성을 나타냈으며, 유전학적으로 Lac. sakei와 75.8%로 가장 낮은 상동성을 나타냈다(Table 1, Fig. 2).
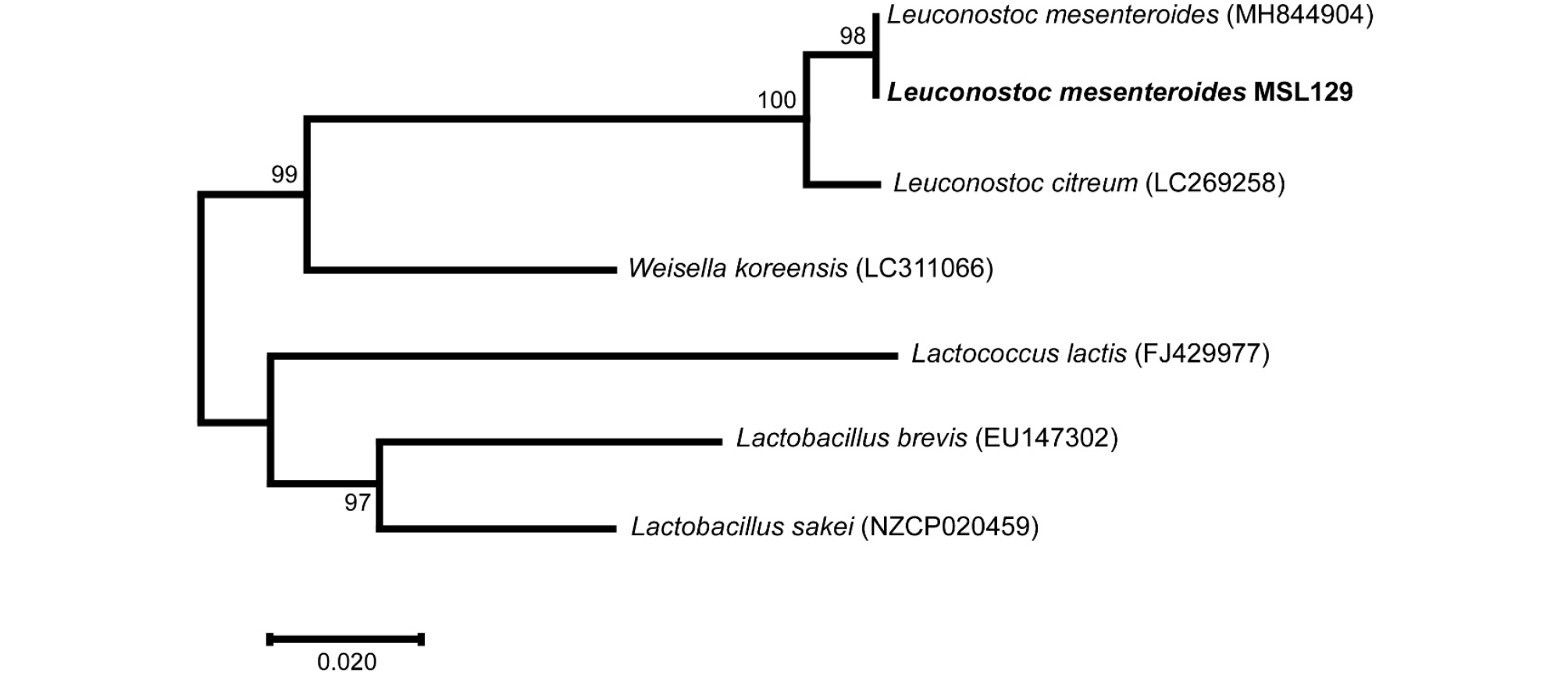
Fig. 2.
A phylogenetic tree based on a 16S rRNA gene sequence using the maximum likelihood method (Kumar et al., 2016). The percentages next to the branches are for the taxa clustered together, based on the total number of taxa within the tree. Genebank accession numbers are shown in parentheses.
김치에서 분리한 Leu. mesenteroides MSL129 균주의 탄수화물 대사 특성을 Leu. mesenteroides KCTC13388 균주를 대조구로 사용하여 조사하였다(Table 2). glucose, galactose, xylose, mannose 등의 탄수화물 대사에서는 대조구 균주와 Leu. mesenteroides MSL129 균주 사이에 유의적인 차이가 나타나지 않았으나, amygdalin, arbutin, cellobiose, gentiobiose는 Leu. mesenteroides MSL129 균주만 대사하는 것으로 나타났다. 또한, Leu. mesenteroides MSL129 균주는 N-acetyl-glucosamine과 salicin의 이용성이 대조구 균주보다 상대적으로 우수하였으며, 이러한 특성은 된장에서 분리한 Leu. mesenteroides YLB 균주(Shim et al., 2014)의 탄수화물 대사특성과 유사하였다.
Table 2. Comparison of carbon source utilization by the Leu. mesenteroides strains
Leu. mesenteroides MSL129 균주의 반응조건에 따른 β-glucosidase 효소활성의 변화를 조사하였다(Fig. 3). β-Glucosidase는 이당류 cellobiose를 두 개의 포도당으로 분해하므로, 미생물이 포도당 이외의 탄소원을 대사하는데 필요한 효소의 생합성 능력을 보유하는지를 판단하는데 사용하는 탄소원이다(Wang et al., 2014). 대조구 균주인 Leu. mesenteroides KCTC13388 균주는 반응온도가 증가할수록 β-glucosidase 효소활성이 증가하는 경향을 나타냈다(Fig. 3A). 반면, Leu. mesenteroides MSL129 균주는 25, 30, 37°C에서 유사한 수준의 β-glucosidase 효소활성을 나타냈으나, 상대적으로 고온인 40°C 이상에서 효소활성이 증가하는 경향을 나타냈다. 그러나 β-glucosidase 효소활성은 45°C에서 대조구인 Leu. mesenteroides KCTC13388 균주가 0.011 ± 0.000 U/mg protein으로 상대적으로 더 높았다. 그러나 Leu. mesenteroides MSL129 균주 유래의 β-glucosidase는 된장에서 분리된 Leu. mesenteroides YLB 균주(Shim et al., 2014)가 30°C 이상에서 β-glucosidase 효소활성이 급격히 감소한 결과와 비교하여 상대적으로 열내성이 우수한 것으로 판단된다.
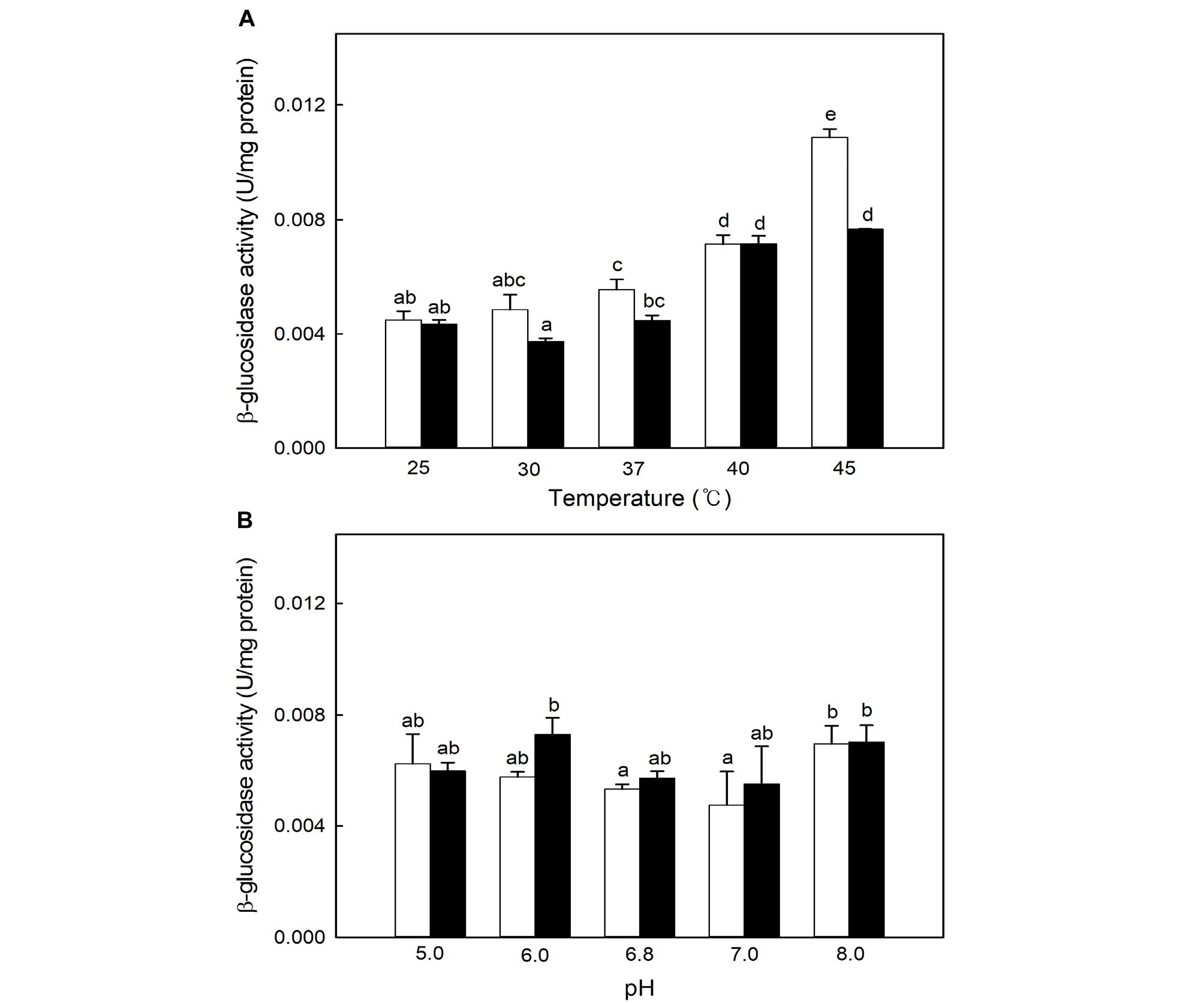
Fig. 3.
Influences of temperature (A) and pH (B) on the extracellular β-glucosidase activities of Leu. mesenteroides KCTC13388 (□) and MSL129 (■). Averages and standard errors determined from the three independent measurements are shown. Different letters indicate significant differences between averages.
반응 pH에 따른 선발 균주의 β-glucosidase 효소활성 변화를 측정하였다(Fig. 3B). 대조구인 Leu. mesenteroides KCTC13388 균주는 반응 pH의 변화에 따른 효소활성의 유의적인 차이가 미미하였으나, Leu. mesenteroides MSL129 균주는 pH 6.0에서 0.007 ± 0.001 U/mg protein으로 가장 높은 효소활성을 나타냈다. 결론적으로, 김치에서 분리한 Leu. mesenteroides MSL129 균주는 pH 6.0, 온도 40°C에서 가장 높은 β-glucosidase 효소활성을 나타냈다.
호반 품종의 콩잎을 이용하여 추출물을 제작한 후, 김치에서 분리한 Leu. mesenteroides MSL129 균주와 대조구인 Leu. mesenteroides KCTC13388 균주를 사용하여 생물전환하고 이소플라본 성분의 변화를 분석하였다(Table 3). 콩잎 추출물은 비배당체 이소플라본으로서 daidzein (0.11 ± 0.00 mg/L)과 genistein (0.11 ± 0.01 mg/L), 배당체 이소플라본 daidzin (5.76 ± 0.04 mg/L), genistin (12.81 ± 0.08 mg/L)을 함유하는 것으로 나타났다.
선발한 균주와 대조구 균주를 사용하여 각각 35°C에서 48시간 동안 생물전환하였다. Leu. mesenteroides MSL129 균주는 배당체 이소플라본인 daidzin이 1.30 ± 0.05 mg/L로 콩잎 추출물보다 약 4.4 mg/L 감소하였으며, 비배당체 이소플라본인 daidzein은 3.35 ± 0.09 mg/L로 약 3.2 mg/L 증가하였다. 대조구인 Leu. mesenteroides KCTC13388 균주는 동일 조건에서 약 1.5 mg/L의 배당체 이소플라본인 daidzin을 소모하여 약 0.9 mg/L의 비배당체 이소플라본인 daidzein을 생산하였다. 따라서 Leu. mesenteroides MSL129 균주가 대조구 균주와 비교하여 배당체 이소플라본인 daidzin에 대한 생물전환 활성이 우수한 것으로 판단되었다.
콩잎추출물에서 가장 높은 함량을 나타낸 배당체 이소플라본인 genistin은 선발균주인 Leu. mesenteroides MSL129를 이용한 생물전환 반응에서 약 12.4 mg/L가 감소한 반면, 대조구 균주인 Leu. mesenteroides KCTC13388을 이용한 생물전환에서는 약 10.3 mg/L 수준으로 소모되었다(Table 3). 생물전환 후 비배당체 이소플라본인 genistein의 함량은 Leu. mesenteroides MSL129 균주를 사용하였을 때 6.17 ± 0.08 mg/L로 Leu. mesenteroides KCTC13388 균주를 사용한 경우(5.33 ± 0.18 mg/L)보다 약 1.2배 많은 것으로 나타났다. 결론적으로 Leu. mesenteroides MSL129 균주는 대조구인 Leu. mesenteroides KCTC13388 균주와 비교하여 daidzein을 약 3배, genistein을 약 1.2배 더 높은 수준으로 생물전환한 것으로 나타났다. 배당체 이소플라본인 daidzin의 생물전환 수율은 Leu. mesenteroides MSL129 균주(73%)가 대조구 Leu. mesenteroides KCTC13388 균주(63%) 보다 약 10% 높은 수율을 나타냈다. Hati 등(Hati et al., 2013)에 따르면, Lac. casei로 daidzin을 생물전환하였을 때 약 54%의 수율을 나타내어, 본 연구를 통해 분리한 Leu. mesenteroides MSL129 균주보다 낮은 수율을 나타냈다.
본 연구를 통하여 김치로부터 분리된 Leu. mesenteroides MSL129 균주 유래의 β-glucosidase 효소가 콩잎추출물에 함유된 배당체인 daidzin을 비배당체 이소플라본인 daidzein으로 생물전환하는 효율이 대조구 균주보다 우수한 것을 확인하였으며, 산업적 활용을 위하여 추가연구가 필요할 것으로 판단된다.
요 약
강원도에서 제작한 김치로부터 112점의 유산균을 분리하여, β-glucosidase 효소활성이 우수한 균주를 선발한 결과 Leuconostoc mesenteroides로 동정되었으며 MSL129 균주로 명명하였다. Leu. mesenteroides MSL129 균주의 β-glucosidase 효소활성은 반응 온도에 따라 점차 증가하는 경향을 나타냈으며, 45°C, pH 6.0에서 가장 우수한 효소활성을 나타냈다. 콩잎추출물을 기질로 사용하였을 때 Leu. mesenteroides MSL129 균주의 비배당체 전환을 분석한 결과 대조구 균주인 Leu. mesenteroides KCTC13388 균주보다 약 3배 많은 비배당체 daidzein을 생산하였다. Leu. mesenteroides MSL129 균주는 콩잎추출물에서 배당체인 daidzin을 비배당체 이소플라본인 daidzein으로 전환하는 능력이 우수하였으며, 한국생물자원센터에 기탁(KCTC13578BP)하였다.




