서 론
최근 국내에서는 지구온난화의 영향으로 인해서 여름철 열대야와 이상 고온 발생일수가 급격하게 증대되고 있다. 포도에서 고온은 1차적으로 안토시아닌의 합성을 저해함으로써 착색을 억제하며, 2차적으로는 착색의 경우 당의 축적과도 밀접한 연관성이 있다는 점에서 주의가 필요하다(Gouot et al., 2019). 실제 주요 작물에서의 착색 불량은 과실 내 당의 축적은 저해하는 반면 산 함량은 증가시키기 때문에 외적 품질뿐만 아니라 내적 품질을 떨어뜨리는 주요한 요인으로 작용한다(Koshita, 2015). 따라서 지구온난화와 함께 포도가 극단적인 고온에 더욱 노출되기 쉬운 시설재배로 변화하고 있는 국내에서 지속성장 가능한 포도의 생산체계를 구축하기 위해서는 착색과 관련된 문제점을 해결하기 위한 연구가 필요한 상황이다.
국내에서 육성된 흑색계 ‘파라다이스’는 기존의 포도 품종들과는 다르게 생장조절제의 1회 처리만으로도 대립계 무핵 포도를 생산해 낼 수 있다(Heo and Park, 2015). 아울러 우수한 품질과 비교적 높은 내한성을 가지고 있어서 강원도를 중심으로 재배면적을 확대해 나가고 있다. 하지만, ‘파라다이스’ 포도는 생장조절제의 처리를 통해서 과실의 비대를 인위적으로 유도하기 때문에 불량환경에 노출될 시 일반적인 포도들에 비해서 착색이 저하될 가능성이 더욱 큰 문제점이 있다.
포도의 착색을 증진하기 위해서 단수와 적엽 같은 재배 적인 방법이 적용되고 있지만, 이는 인건비 부담이 큰 노동력이 많이 투여되는 단점이 있어 화학 약제의 처리를 통한 문제 해결에도 많은 관심이 이루어져 왔으며, 그 결과 abscisic acid (ABA)의 외생적 처리방법이 고안되어 적용되고 있다. 실례로 포도를 대상으로 변색기에 ABA를 처리할 경우 과실품질의 저하 없이 착색이 향상되었다는 보고가 있다(Shin and Park, 2012; Yamamoto et al., 2015). 하지만, 적정농도를 벗어난 ABA의 처리는 과실의 연화와 당도의 저하와 같은 부작용을 일으킬 수 있다는 보고도 존재하기 때문에 포도에서 ABA를 처리하고자 하는 경우에는 많은 주의가 필요하다(Kataoka et al., 1982; Hiratsuka et al., 1990). 아울러, ABA 처리에 따른 실질적 효과는 포도 품종들이 가진 고유의 유전적 특성에 따라서 달리 나타날 수 있어, 착색 증진을 목적으로 농가에서 ABA를 적용하기 위해서는 ABA 사용 가능 여부에 대한 구명 과정이 선행되어야 한다. 따라서 본 연구에서는 ‘파라다이스’ 포도를 대상으로 다양한 농도의 ABA 처리 시 과실의 착색과 품질에 미치는 영향을 종합적으로 검토함으로써, ‘파라다이스’ 포도에서 발생할 수 있는 착색 불량현상에 대응한 방법으로서 ABA의 적용 가능성에 대해서 실험하였다.
재료 및 방법
본 시험은 강원도 춘천시 소재의 강원대학교 시험 연구 포장에서 재배되고 있는 6년생 3배체 ‘파라다이스’ 품종을 이용하여 수행하였다. ABA (Sigma, USA) 처리가 과실의 착색과 품질에 미치는 영향을 검정하기 위해서 ‘파라다이스’의 변색기인 8월 3일에 서로 다른 농도의 ABA (25, 50, 75 또는 100 µM)를 완전 임의로 화방에 직접 침지 처리하였으며, 과실의 착색과 품질의 검정을 위한 재료는 ABA 처리 후 60일 차에 5송이씩 무작위로 수확한 송이로부터 확보하였다.
과실의 착색 정도는 색차계(CR-400, Minolta, Japan)를 사용하여 과립의 적도부의 Hunter Value (L, a 및 b)와 Anthocyanin 함량을 측정하는 방식으로 평가하였다. 과피의 안토시아닌 함량은 Hosseinian et al. (2008)의 pH differential method를 이용하여 spectro photometer (Thermofisher Scientific, USA)를 활용하여 측정하였다.
과실의 품질은 과립과 과방의 크기, 과일의 경도, 과일의 당도와 산도 및 기능성 물질함량을 측정하는 방식을 이용하였다. 과립과 과방의 크기는 미세저울, 일반저울 및 버니어캘리퍼스 등을 이용하여 측정하였다. 과립의 경도는 적도부를 기준점으로 직경 2 mm plunger가 장착된 물성분석기를 이용하여 1 mm ‧ s-1 속도로 5 mm 깊이까지 압축강도를 측정하여 계측된 뉴턴(N) 단위로 표기하였다. 당도는 과립의 착즙액을 이용하여 굴절 당도계(N1, Atago Hand Refract-ometer, Japan)로 측정하였으며 산도는 착즙액 0.3 mL에 증류수 29.7 mL를 혼합하여 희석한 액체를 이용하여 산도측정기(SAM-706AC, Jiwon High-Tech, Korea)로 측정하였다.
과피에서의 레스베라트롤 함량은 Kim et al. (2006)의 방법으로 기반으로 하여 HPLC 기기(2695, Waters, USA)를 활용하여 측정하였으며, 총 폴리페놀 함량은 Anesini et al. (2008)의 실험을 변형하여 측정하였다. 가령 1차로 시료 1 mL에 1.0 mL의 Folin-Ciosalreu 시약을 가하고 3분간 실온에서 반응시켰으며, 이후 0.3 mL 탄산나트륨(Na2CO3)용액을 첨가하여 90분 동안 실온에서 반응시킨 후 spectro photometer (Thermofisher Scientific, USA)를 사용하여 725 nm에서 흡광도를 측정하였다. 각각의 측정 결과는 galiic acid로 작성한 표준 검량선을 활용하여 함량을 산출하였다. 수집된 모든 데이터의 통계분석은 SPSS (SPSS Inc., ver. 21, USA) 프로그램을 이용하여 수행하였다.
결과 및 고찰
변색기 후 60일 차에 수확되어 검정 된 착색과 밀접하게 관련 있는 안토시아닌의 함량의 경우, 무처리구에서는 10.85 mg/kg-1에 불과했던 반면에, ABA 처리 시에는 처리 농도가 높아짐에 따라서 안토시아닌의 축적량도 많아져 최소 14.08에서 최대 27.50 mg/kg-1 함량을 보이는 것으로 나타났다(Fig. 1). 이러한 착색의 변화는 ABA 처리 후 육안으로도 쉽게 관찰할 수 있었을 뿐만 아니라 Hunter value 및 외관을 통해서도 확연한 차이를 확인할 수 있었다(Fig. 2, Table 1). ABA 무처리구와 4가지의 ABA 처리구(25, 50, 75 및 100 µM)에 측정된 Hunter L값은 24.95, 24.53, 24.47, 23.09와 22.70로써 안토시아닌 함량과 마찬가지로 ABA 농도가 높아질수록 Hunter L값이 감소하는 경향을 볼 수 있었다. 이는 포도에서 착색기에 ABA의 인위적인 처리가 안토시아닌의 함량을 급속도로 증진시킴으로서 착색 향상을 유도할 수 있다는 기존의 결과들과 일치하는 것이었다(Wheeler et al., 2009; Sun et al., 2010; Ferrara et al., 2015; Murcia et al., 2018).
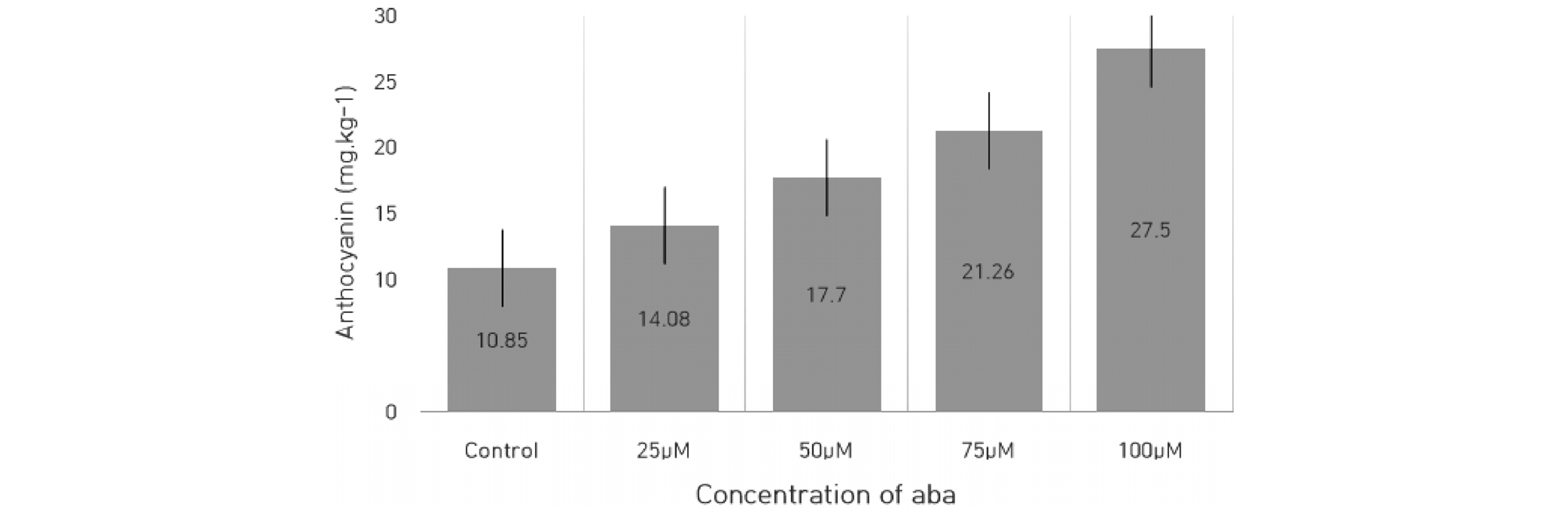
Fig. 1.
Effects of ABA on the anthocyanin content in ‘Paradise’ grapes.

Fig. 2.
Seasonal changes of coloration by ABA treatment in ‘Paradise’ grapes.
Table 1. Comparison of fruit coloration at different ABA treatment of ‘Paradise’ grapes
|
Concentration of ABA (μM)
|
Hunter value1) |
|
L
|
A
|
b
|
|
Control
|
24.95a2) |
-0.76a
|
-0.42a
|
|
25
|
24.53a
|
-0.31bc
|
-0.60b
|
|
50
|
24.47a
|
-0.73bc
|
-0.63b
|
|
75
|
23.09b
|
-0.03ab
|
-0.68b
|
|
100
|
22.70b
|
-1.04c
|
-0.71b
|
1)L, 0 (dark)-100 (light); a, -60 (green)-60 (red); b, -60 (blue)-60 (yellow).
2)Mean separation within each columns by Duncan’s multiple range test, 5% level.
ABA 처리에 따른 주요 과실의 특성은 Table 2에 나타낸 것과 같다. 과방중과 과립중은 343.4-367.0 g 및 6.87-7.34 g의 범위를 나타냈으며 ABA 처리구에서 무처구 보다 전반적으로 높은 양상이 나타났지만, 무처리구와의 통계적인 유의성은 인정되지 않아 ABA 처리가 ‘파라다이스’ 포도의 과실 비대에 끼치는 영향은 미비한 것으로 조사되었다.
Table 2. Effect of different ABA concentrations on fruit size in ‘Paradise’ grapes
|
Concentration of ABA
(μM)
|
Cluster weight
(g)
|
Berry weight
(g)
|
Berry length
(mm)
|
Berry diameter
(mm)
|
|
Control
|
344.5a1) |
6.89a
|
22.54a
|
21.39b
|
|
25
|
343.4a
|
6.87a
|
22.18a
|
21.34b
|
|
50
|
350.5a
|
7.00a
|
22.30a
|
21.28b
|
|
75
|
348.8a
|
6.98a
|
22.28a
|
21.53b
|
|
100
|
367.0a
|
7.34a
|
23.24a
|
23.15a
|
1)Mean separation within each columns by Duncan’s multiple range test, 5% level.
이는 ABA가 포도 품종의 유전적 특성에 따라서 성숙을 촉진하는 역할을 할 수 있지만, 세포의 분열이나 비대생장을 촉진하는 특성은 없어 과실의 비대에는 큰 영향을 주기 어렵다는 다른 연구자의 보고와 일치하는 것이었다(Han, 2005). 하지만, 가용성당함량은 ABA 처리 농도의 증대와 함께 통계적인 유의성을 보이면서 높아진 반면에, 적정 산함량은 낮아지는 양상이 나타나 품질의 변화를 유도하는 것을 관찰할 수 있었다(Table 3). 이는 ABA의 처리가 이루어졌던 과실에서 안토시아닌의 축적이 원활하게 이루어짐에 따라서 과실의 성숙이 유도되어 나타나는 현상으로 추론되었다. 실제 과실의 성숙도에 따라서 변화하는 과육의 경도도 ABA 50, 75 및 100µM 농도의 처리구에서 6.5-6.6 N으로 조사된 반면에, 무처리구에서는 9.5 N로 조사되어 ABA 처리가 과실의 성숙과 연화를 빠르게 유도하는 것을 확인할 수 있었다. 포도가 가진 중요한 기능성 물질들인 총 페놀과 레스베라트롤 함량을 검정한 결과에서도 ABA 처리구에서 월등하게 높은 함량이 나타나는 것으로 조사되었다. Ban et al. (2000)과 Yamamoto et al. (2015)도 ABA 처리구에서의 폴리페놀과 레스베라트롤 함량이 월등하게 높게 나타났다는 결과를 제시한 바가 있으며, Zheng et al. (2017)은 이러한 결과가 ABA의 경우 페놀화합물과 레스베라트롤의 축적과 관련된 신호인자들의 발현을 촉진하는 역할도 있기 때문에 발생하는 현상이라고 보고한 바 있다. 본 실험에서도 고농도의 ABA 처리구에서 주요 기능성 물질의 함량이 더욱 높게 조사된 것을 고려해 볼 때, 이들 또한 외생 ABA 처리에 따른 긍정적인 결과로 판단되었다(Table 3).
Table 3. Effect of different ABA concentrations on fruit characteristics in ‘Paradise’ grapes
Concentration of ABA
(μM)
|
Soluble solids
(°Bx)
|
Titratable acidity
(%)
|
Fruit firmness
(N)
|
Resveratrol content
(μg/100 g-1)
|
Polyphenol content
(μg/g-1)
|
|
Control
|
18.4b1) |
0.54a
|
9.45
|
2.80
|
303.6
|
|
25
|
19.5ab
|
0.52a
|
9.30
|
3.33
|
318.6
|
|
50
|
19.8a
|
0.46b
|
6.60
|
4.94
|
323.9
|
|
75
|
20.0a
|
0.47b
|
6.52
|
5.90
|
352.8
|
|
100
|
20.2a
|
0.45b
|
6.48
|
18.09
|
453.9
|
1)Mean separation within each columns by Duncan’s multiple range test, 5% level.
과실의 착색은 향이나 미각과 함께 과실의 품질을 결정하는 중요 요인이기 때문에 동일한 품종에서 상품성이 높은 과실은 착색이 잘 된 것으로 정의할 수 있다(Yim, 2015). 최근에 나타나고 있는 기후의 변화 양상은 원예작물의 생육기에 온도 변화를 일으킴으로써 생산량과 품질에 영향을 미치고 있다. 특히 최근 빈번하게 발생하고 있는 이상 고온현상은 과수작물에서 수체 생육의 저하는 물론이고 소비자들이 중요하게 여기는 과피의 착색과 당과 산 함량 등에 부정적인 영향을 미치고 있다(Florides and Christodoulides, 2009; Son et al., 2014). 포도에서도 변색기의 고온은 포도 과피의 안토시아닌 조성 변화에 영향을 미침으로써 착색을 지연시키고 있어 많은 문제가 되고 있다(Mori et al., 2004; Shinomiya et al., 2015; Ryu et al., 2015). 이는 고온이 포도에서 안토시아닌과 같은 물질들의 축적을 억제하는 반면에, ABA의 생성은 억제함으로써 과실의 전체적인 성숙을 지연하는 것으로 보고 된 바 있다(Movahed et al., 2016). 이러한 기존의 보고와 함께 본 연구자의 실험 결과를 종합적으로 고려하였을 때 ‘파라다이스’ 포도의 성숙과정에서 발생할 수 있는 착색 불량현상은 ABA의 처리를 통해서 해결을 고려해 볼 수 있는 것으로 판단된다. 하지만, ABA 처리에 따른 착색 증진 효과를 실질적으로 구명하기 위해서는 착색과 연관된 유전자발현 경로와 내생 ABA 농도에 대한 추적도 필요할 것으로 사료 된다. 아울러 상업적인 가치의 극대화를 위해서는 추후 다양한 처리 농도가 수확기 및 수확 후 선도 유지에 미치는 영향에 대해서 검토가 필요할 것으로 보인다.
Acknowledgements
본 연구는 강원대학교 전임교원 연구비사업(D1001233-01-01)으로 수행된 연구결과입니다.
References
Anesini, C., Ferraro, G. E., Filip, R. (2008) Total polyphenol content and antioxidant capacity of commercially available tea (
Camellia sinensis)) in Argentina. J Agric Food Chem 56:9225-9229.
Ban, T., Shiozaki, S., Ogata, T., Horiuchi, S. (2000) Effects of abscisic acid and shading treatments on the levels of anthocyanin and resveratrol in skin of Kyoho grape berry. Acta Hortic 514:83-89.
Ferrara, G., Mazzeo, A., Matarrese, A. M. S., Pacucci, C., Punzi, R., Faccia, M., Trani, A., Gambacorta, G. (2015) Application of abscisic acid (S-ABA) and sucrose to improve colour, anthocyanin content and antioxidant activity of cv. Crimson Seedless grape berries. Aust J Grape Wine Res 21:18-29.
Florides, G. A., Christodoulides, P. (2009) Global warming and carbon dioxide through sciences. Environ Int 35:390-401.
Gouot, J. C., Smith, J. P., Holzapfel, B. P., Walker, A. R., Barril, C. (2019) Grape berry flavonoids: a review of their biochemical responses to high and extreme high temperatures. J Exp Bot 70:397-423.
Han, D. H. (2005) Influence of exogenous abscisic acid concentration on the coloration of 'Kyoho' grapes. J Life Sci 15:293-297.
Heo, J. Y., Park, S. M. (2015) Breeding of a new triploid seedless table grape cultivar 'Paradise'. J Am Pomol Soc 69:170-172.
Hiratsuka, S., Onodera, H., Matsushima, J. (1990) Research on colour production in grape cv. Olympia: Fruit shape and anthocyanin development in small fruits. Agric Hortic 65:531-534.
Hosseinian, F. S., Li, W., Beta, T. (2008) Measurement of anthocyanins and other phytochemicals in purple wheat. Food Chem 109:916-924.
Kataoka, I., Sugirura, A., Utsunomiya, N., Tomana, T. (1982) Effect of abscisic acid and defoliation on anthocyanin accumulation in Kyoho grapes (
Vitis vinifera L. x
V. labruscana BAILEY). Vitis 21:325-332.
Kim, H. W., Chu, S. M., Lee, D. J. (2006) Determination of resveratrol content in grapes and wines. Korean J Crop Sci 51:259-263.
Koshita, Y. (2015) Effect of temperature on fruit color development. pp.47-58. In: Kanayama, Y., Kochetov, A., Abiotic Stress Biology in Horticultural Plants. Springer, Berlin, Germany.
Mori, K., Sugaya, S., Gemma, H. (2004) Regulatory mechanism of anthocyanin biosynthesis in 'Kyoho' grape berries grown under different temperature conditions. Environ Control Biol 42:21-30.
Movahed, N., Pastore, C., Cellini, A., Allegro, G., Valentini, G., Zenoni, S., Cavallini, E., D'Incà, E., Tornielli, G. B., Filippetti, I. (2016) The grapevine VviPrx31 peroxidase as a candidate gene involved in anthocyanin degradation in ripening berries under high temperature. J Plant Res 129:513-526.
Murcia, G., Pontin, M., Piccoli, P. (2018) Role of ABA and Gibberellin A
3 on gene expression pattern of sugar transporters and invertases in
Vitis vinifera cv. Malbec during berry ripening. Plant Growth Regul 84:275-283.
Ryu, S. H., Kwon, Y. H., Do, K. R., Han, J. H., Han, H. H., Lee, H. C. (2015) Physiological responses and fruit quality changes of 'Fuji' apple under the high night temperature. Protected Hort Plant Fac 24:264-270.
Shin, H. K., Park, H. S. (2012) Fruit color improvement by ABA treatment and determination of harvesting time in 'Hongisul' grapes. Korean J Hortic Sci Technol 30:256-260.
Shinomiya, R., Fujishima, H., Muramoto, K., Shiraish, M. (2015) Impact of temperature and sunlight on the skin coloration of the 'Kyoho' table grape. Sci Hortic 193:77-83.
Son, I. C., Han, J. H., Cho, J. G., Kim, S. H., Chang, E. H., Oh, S. I., Moon, K. H., Choi, I. M. (2014) Effects of the elevated temperature and carbon dioxide on vine growth and fruit quality of 'Campbell Early' grapevines (
Vitis labruscana). Korean J Hortic Sci Technol 32:781-787.
Sun, L., Zhang, M., Ren, J., Qi, J., Zhang, G., Leng, P. (2010) Reciprocity between abscisic acid and ethylene at the onset of berry ripening and after harvest. BMC Plant Biol 10:257.
Wheeler, S., Loveys, B., Ford, C., Davies, C. (2009) The relationship between the expression of abscisic acid biosynthesis genes, accumulation of abscisic acid and the promotion of
Vitis vinifera L. berry ripening by abscisic acid. Aust J Grape Wine Res 15:195-204.
Yamamoto, L. Y., de Assis, A. M., Roberto, S. R., Bovolenta, Y. R., Nixdorf, S. L., Garcia-Romero, E., Gómez-Alonso, S., Hermosín-Gutiérrez, I. (2015) Application of abscisic acid (
S-ABA) to cv. Isabel grapes (
Vitis vinifera x
Vitis labrusca) for color improvement: effects on color, phenolic composition and antioxidant capacity of their grape juice. Food Res Int 77:572-583.
Yim, Y. J. (2015) Fruit science general (1st ed). pp.212-214. Hyangmoonsha Press, Seoul, Korea.
Zheng, X., Shi, J., Yu, Y., Shen, Y., Tan, B., Ye, X., Li, J., Feng, J. (2017) Exploration of elite stilbene synthase alleles for resveratrol concentration in wild chinese
Vitis spp. and
Vitis Cultivars. Front Plant Sci 8:487.






