서 론
아스파라거스는 백합과에 속하는 다년생 식물로서 1966년 첫 시험재배를 시작한 이후 전국적으로 약 85 ha 정도가 재배되고 있으며 양구, 춘천 등 강원도 지역이 전체 재배면적의 62%를 차지하고 있다. 우리나라에서 아스파라거스를 가해하는 해충은 크게 나방류(잎말이나방류, 담배거세미나방, 파밤나방, 왕담배나방 등), 진딧물류(목화진딧물, 복숭아혹진딧물 등), 딱정벌레류(아스파라거스잎벌레), 잎응애류(점박이응애, 차응애 등), 총채벌레류 해충 등이 있으며 그 중 특히 양구지역 아스파라거스 재배지에서 문제가 되는 해충은 총채벌레류 해충이다. 총채벌레류 해충 중 아스파라거스에서 발견되는 것은 꽃노랑총채벌레(Frankliniella occidentalis), 대만총채벌레(Frankliniella intonsa), 파총채벌레(Thrips tabaci), 그리고 오이총채벌레(Thrips palmi) 등 4종류이며 이 중 특히 파총채벌레가 봄 수확기를 비롯하여 아스파라거스 재배 전시기에 걸쳐 높은 빈도로 나타나며 피해를 주며 방제에 큰 어려움을 겪고 있다(Choi et al., 2014; Jeon and Kim, 2018).
아스파라거스를 가해하는 총채벌레류 해충을 방제하기 위한 방법으로는 크게 끈끈이트랩을 이용하는 방법, 살충제를 처리하는 방법, 친환경유기농자재를 이용하는 방법, 이산화탄소를 이용하는 방법, 그리고 비눗물을 이용하는 방법 등이 있다. 이 중 가장 효과적은 방법은 살충제를 처리하는 것이나 아스파라거스의 경우 매일 수확하기 때문에 수확기에는 살충제 처리가 용이하지 않아 파총채벌레 방제가 쉽지 않다. 본 연구에서는 강원도 양구지역 아스파라거스 포장에서 발생하는 파총채벌레의 발생양상과 이들 해충을 방제하기 위한 종합적 방제방안에 대해 살펴보고자 한다.
총채벌레 생활사 및 발생양상
총채벌레는 총채벌레목(Thysanoptera)에 속하는 크기가 2-3 mm에 달하는 미소곤충으로 우리나라에는 83종이 알려져 있으며 대부분 식물을 가해하는 해충으로 알려져 있다(National Species List of Korea, 2018). 총채벌레는 다양한 시설작물과 화훼류에 토마토반점시들음바이러스(tomato spotted-wilt virus, TSWV)를 매개하여 심각한 피해를 입힌다. 우리나라 아스파라거스에서 발견되는 총채벌레는 5종이 있으며 그 중 강원도 지역의 아스파라거스 포장에 심각한 피해를 입히는 것은 파총채벌레이다(Jeon and Kim, 2018). 총채벌레는 유성생식으로 번식하기도 하지만 주로 무성생식으로 번식하며 처녀생식을 통해 미수정된 알이 암컷이 되거나(thelytoky) 어떤 경우에는 미수정란이 수컷으로 발생한다(arrhenotoky).
총채벌레는 알, 유충(1-2령), 번데기(전용, 후용), 성충의 단계를 거친다. 총채벌레는 번데기시기를 토양에서 보내기 때문에 토양 내 습도가 높은 시기에는 대발생하지 않는다. 이는 토양 내 습도가 높으면 곰팡이나 세균 등에 의해 번데기가 공격받을 가능성이 높기 때문에 총채벌레의 발생이 줄어드는 것으로 알려져 있다. 번식은 암컷과 수컷이 교미해서 수정된 알을 낳는 유성생식도 일어나지만 대부분의 경우 암컷 혼자서 알을 낳는 무성생식(처녀생식)으로 번식하기 때문에 단기간에 밀도가 폭발적으로 증가한다.
파총채벌레는 입경(6월 초, 중순)전에는 낮은 밀도를 유지하다 입경 이후 특히 6월 하순부터 고온 건조한 기상조건에서 발생이 급격히 증가하여 큰 피해를 입히며 특히 아스파라거스 순 속에 숨어 있어 방제가 쉽지 않다. 파총채벌레는 온실 내의 적합한 환경에서 연 10회 이상 발생하는 것으로 추정된다. 제주도의 경우 강원도 지역과는 달리 파총채벌레와 하와이총채벌레가 아스파라거스에서 발견되며 파총채벌레의 경우 3월경 발생밀도가 증가했다가 봄 수확기에 지상부의 아스파라거스 순이 수확되면서 밀도가 낮아지며, 입경이후 2차례에 걸쳐(6월 하순-7월 상순, 9월 하순-10월 상순) 밀도가 증가하였다(Choi et al., 2014). 양구지역의 경우 제주도와는 달리 낮은 기온으로 인해 4월 중순까지는 파총채벌레의 밀도 증가가 거의 없다가 5월 중순 이후 조금씩 증가하기 시작하여 6월 중순 이후 급격히 증가한다(Jeon and Kim, 2018). 하와이 총채벌레는 강원도 지역에서는 발견되지 않으며 파총채벌레 이외에 꽃노랑총채벌레, 대만총채벌레가 주로 함께 발견되며 특히 오이총채벌레의 경우 높은 기온을 선호하여 주로 남부에서 발견되는 종으로 2015년과 2016년에는 강원도 양구지역 아스파라거스 포장에서는 거의 발견되지 않았으나 2017년 그 수가 증가하여 30여 개체 이상 발견되어 강원도 지역으로의 확산 가능성이 있으므로 면밀한 관찰이 필요하다. 아직까지 오이총채벌레에 의한 아스파라거스의 피해는 보고된 바가 없다.
화학적 방제
아스파라거스에 발생하는 주요 해충에 대한 방제는 주로 살충제를 처리하는 화학적인 방법에 의존하였다. 아스파라거스에 발생하는 해충을 방제하기 위해 적용가능한 살충제는 총 114종이 등록되어 있으며 그 중 총채벌레 방제용 살충제는 60종이 등록되어 있다(RDA, 2019). 등록된 살충제 중 abamectin 또는 emamectin benzoate를 주성분으로 하는 품목이 전체의 80%를 차지한다(Fig. 1). 그러나 최근 꽃노랑총채벌레 등 약제 저항성 계통의 출현이 지속적으로 보고되고 있어 화학적 방제만으로는 효과적인 방제가 힘든 것으로 알려져 있다(Cho et al., 1995; Bielza et al., 2007; Li et al., 2016). 파총채벌레 방제에 주로 사용되었던 유기인제(organophosphate) 살충제인 디아지논(diazinon), 메틸 파라치온(methyl parathion)과 합성피레스로이드계(synthetic pyrethroid) 살충제인 퍼메트린(permethrin), 사이퍼메트린(cypermethrin), 델타메트린(deltamethrin) 등에 대해 파총채벌레의 저항성 획득이 보고되었다(Gill et al., 2015). 최근 중국에서 수행된 연구결과에 따르면 꽃노랑총채벌레의 경우 총채벌레 방제에 일반적으로 이용되는 스피노사드(spinosad) 성분의 살충제에 저항성을 획득한 것으로 알려졌다(Gao et al., 2012; Li et al., 2016). 스피노사드는 스피노신(spinosyn) 계열의 미생물에서 유래한 살충제로 곤충의 신경계에 존재하는 니코틴성 아세틸콜린 수용기(Nicotinic acetylcholine receptor (nAChR))에 작용한다. 총채벌레는 IRAC MOA class 중 1A (carbamates), 1B (organophosphate), 2A (yyclodiene/organochlorines), 2B (fiproles), 3A (pyrethroids), 4A (neonicotinoids), 5 (spinosyns), 6 (avermectins)에 대해 높은 저항성을 획득한 것으로 알려져 있다(Gao et al., 2012). 또한 꽃노랑총채벌레는 광범위하고 빈번하게 사용되는 살충제 중의 하나인 네오니코티노이드(neonicotinoids) 계열 살충제인 이미다클로프리드(imidacloprid)에 대한 저항성이 특히 높은 것으로 알려져 있다(Gao et al., 2012). 아세타미프리드, 클로치아니딘, 디노테퓨란, 이미다클로프리드, 치아클로프리드, 치아메톡삼은 모두 네오니코티노이드계 살충제로 니코틴성아세틸콜린수용체(nicotinic acetylcholine receptor)에 작용하기 때문에 동일한 살충 기작을 가진다. 따라서 아세타미프리드에 저항성을 갖는 곤충은 동일한 방법으로 작용하는 다른 약제에 대해서도 저항성을 갖는 교차저항성을 획득하기 때문에 약제의 효능이 저하된다. 따라서 살충제를 처리할 경우에는 저항성 또는 교차저항성 획득을 최소화하기 위해 작용점(살충방법)이 상이한 약제를 교호살포 해야 한다. 살충제의 작용방법에 따른 분류는 IRAC (Insecticide Resistance Action Committee)의 분류표를 참고하여 해당 약제의 작용밥법을 정확하게 숙지한 다음 적용해야 교차저항성 획득을 최소화할 수 있다(IRAC, 2019). 아스파라거스 총채벌레 방제용으로 등록된 살충제의 성분에 따른 작용방법을 표에 정리하였다(Table 1).
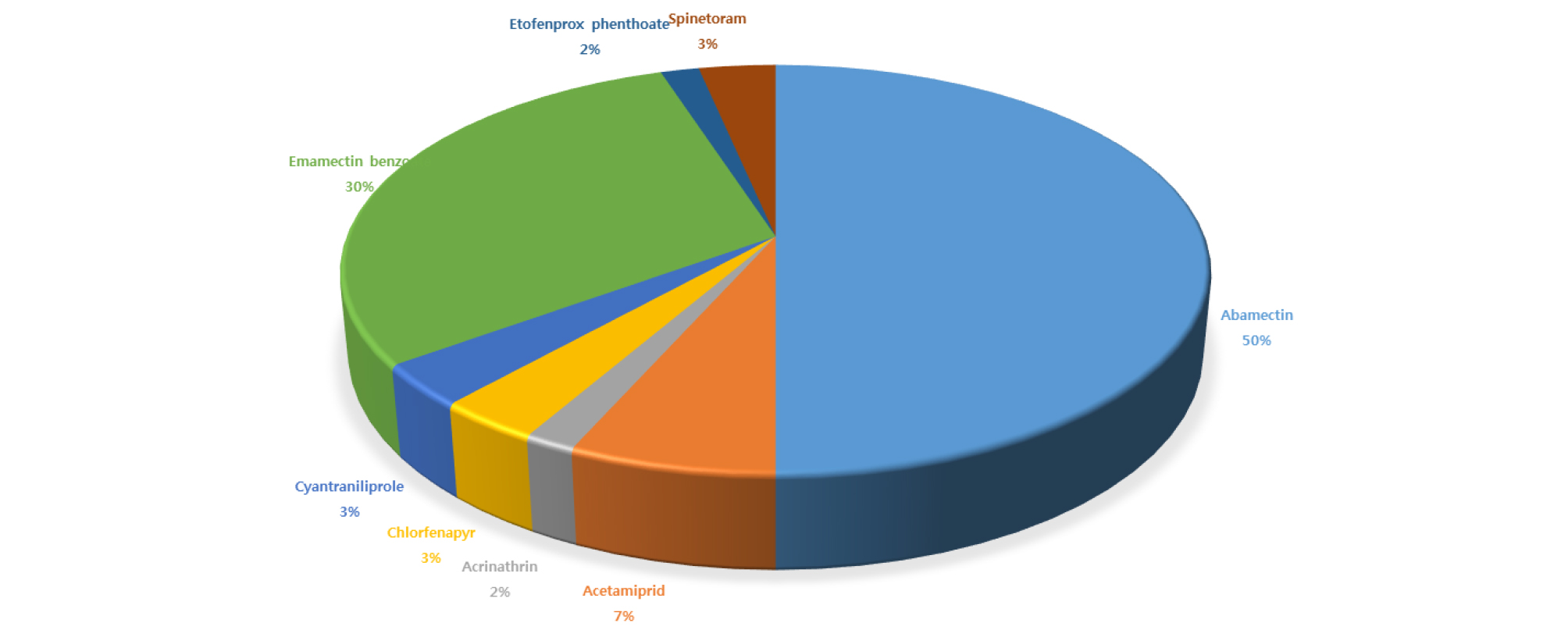
Fig. 1.
Proportion of insecticides based on active ingredients registered for control of onion thrips of asparagus (RDA, 2019).
Table 1. Active ingredients and modes of action of registered insecticides for control of onion thrips of asparagus
IRAC, 2019).봄 수확기에 살충제를 처리할 경우에는 농약허용물질목록관리제도(PLS)에 따라 아스파라거스에 적용이 허용된 약제를 살포해야 한다. 아스파라거스 파총채벌레 방제에 빈번하게 이용되고 있는 아세타미프리드(acetamiprid)의 경우 잔류량은 살포 후 3일이 경과하였을 때 급격히 감소하여 잔류허용량(0.1 mg/kg) 미만으로 검출되었고 5일이 경과하였을 때 정량한계 미만(<0.02 mg/kg)으로 감소하므로, 수확 7일 전 1회 살포하는 것은 적용되는 농약잔류허용기준에 아무런 문제가 되지 않을 것으로 보인다(Kim et al., 2015). 현재까지 아스파라거스에 적용가능한 살충제의 잔류특성에 대한 연구는 acetamiprid와 dinotefuran에 대한 연구가 수행되었으며(Kim et al., 2015; Boo, 2018) 다른 성분에 대한 연구도 진행 중에 있다.
끈끈이트랩
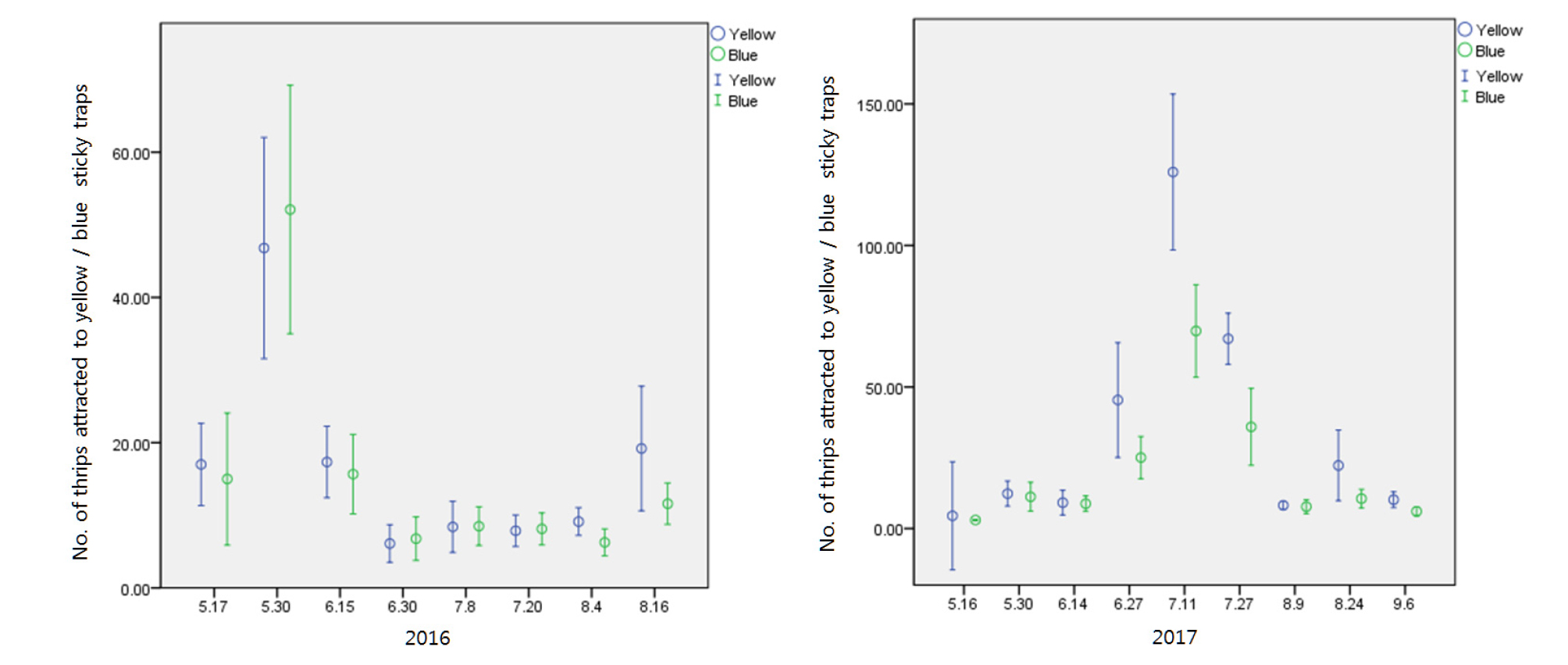
끈끈이 트랩(sticky trap)은 주로 총채벌레 예찰에 사용하지만 살충제를 살포하지 않고 봄 수확기 총채벌레 개체수를 줄이는데 큰 효과가 있다. 총채벌레의 경우 일반적으로 노란색 보다는 파란색 끈끈이 트랩에 더 잘 유인되는 것으로 알려져 있으나 총채벌레 종류에 따라 유인되는 색깔이 다르다. 연구에 따르면 흰색이나 파란색 보다 노란색 끈끈이 트랩이 꽃노랑총채벌레 유인효과가 큰 것으로 나타났으나(Cho et al., 1995; Demirel and Cranshaw, 2005)다른 연구에서는 파란색의 유인효과가 더 크거나(Gillespie and Vernon, 1990; Natwick et al., 2007), 흰색의 유인효과가 크게 나타났다(Hoddle et al., 2002). 대만총채벌레의 경우 흰색이나 노란색 보다는 파란색 끈끈이 트랩에 더 많이 유인되는 경향성을 보였다(Seo et al., 2006). 그러나 일부 연구에 따르면 연구를 수행한 연도에 따라 노란색과 파란색 끈끈이 트랩의 파총채벌레 유인효과가 다르게 나타났다. 2006년에는 노란색 끈끈이 트랩이 파란색에 비해 훨씬 더 높은 유인효과를 나타냈으나 2007년에는 파란색에 유인되는 총채벌레가 훨씬 더 많았다(Demirel and Yildirim, 2008). 제주도의 경우에는 노란색 보다는 흰색 끈끈이 트랩에 더 잘 유인되는 경향성을 보여 흰색 끈끈이 트랩을 이용하여 아스파라거스 총채벌레를 조사하였다(Choi et al., 2014). 최근 강원도 아스파라거스 포장에서 수행된 연구결과에 따르면(Jeon and Kim, 2018) 강원도 아스파라거스의 주요해충인 파총채벌레는 색상에 대한 선호도가 연도에 따라 약간의 차이를 보였는데 2016년도에는 노란색과 파란색 끈끈이 트랩에 유인된 파총채벌레의 차이가 없었으나 2017년도에는 파란색 보다는 노란색 끈끈이 트랩에 더 많이 유인되었다(Fig. 2). 총채벌레의 색깔에 대한 다양한 유인효과는 빛의 파장과 깊은 연관관계가 있으며 연구결과에 따르면 파란색 끈끈이 트랩은 400-500 nm 파장을 반사하고, 노란색 끈끈이 트랩은 550-700 nm 파장을 반사시키는 것으로 알려져 있다(Natwick et al., 2007). 또한 시간의 흐름에 따라 총채벌레의 선호하는 색상이 달라지기도 하는데 이는 시간에 따른 빛 반사량의 차이 또는 식물의 변화에 따른 것으로 여겨진다(Hoddle et al., 2002).
물리적 방제
아스파라거스로부터 총채벌레를 제거하는 방법 중 비눗물을 이용한 세척(washing)은 아스파라거스 순에 숨어 있는 파총채벌레를 제거하는 효과적인 방법이다. 이 방법은 비눗물의 계면활성제 성분으로 인해 곤충표면의 기문을 통한 호흡을 억제하여 곤충을 살충하는 것으로 상온에서 1-2%로 희석한 세제용액에 아스파라거스를 30분 동안 담 근 후 흐르는 물에 5분 정도 헹구면 97%이상의 총채벌레 제거효과를 볼 수 있다(Waller, 1990). 그러나 높은 온도는 아스파라거스의 신선도 유지에 좋지 않기 때문에 4°C의 1,000배 희석한 비눗물에 총채벌레가 발생한 아스파라거스를 15분 동안 침지 시켰을 때 높은 살충효과를 얻을 수 있다(unpublished data). 그러나 죽은 파총채벌레가 아스파라거스 순에 그대로 존재하는 경우가 있으므로 흐르는 물에 철저히 헹궈 아스파라거스 순으로부터 죽은 총채벌레를 제거하는 것이 필요하다(Fig. 3). 또한 아스파라거스 순에 물기가 묻은 상태로 오래 보관하게 되면 순이 물러지므로 세척, 헹굼 후에는 물기를 최대한 신속하게 제거해야 한다.
이산화탄소
이산화탄소에 의한 곤충의 살충효과는 대기 중 높은 농도의 이산화탄소로 인해 상대적으로 산소농도가 낮아지고 이로 인해 곤충은 좀 더 오랜 시간동안 기문(spiracle)을 열게 되어 몸속의 수분을 잃음으로써 죽게 된다. 이산화탄소를 이용한 해충 방제는 1990년대부터 총채벌레를 대상으로 몇몇 연구가 이루어졌으며 최근 고농도의 이산화탄소를 이용하여 총채벌레 알에 대한 살충력 평가가 이루어졌다(Seki and Murai, 2012). 또한 이산화탄소를 이용한 해충 방제시 아스파라거스의 품질에 미치는 영향에 대한 연구도 진행되었다(Corrigan and Carpenter, 1993). 아스파라거스에 발생하는 파총채벌레를 방제하기 위한 최근 연구를 살펴보면 고농도(60%)의 이산화탄소 농도에서 온도와 처리시간에 따른 살충효과는 저온(4°C)에서는 처리시간에 따라 91-96%의 살충효과를 나타냈으나 고온(20°C)에서는 100% 살충율을 나타냈다(Kim, 2017). 그러나 40%의 이산화탄소 농도에서 100% 살충률을 나타내기 위해서는 24°C에서 24시간 동안 처리하였을 때 가능하였다(Kim, 2017). 특히 유충의 경우 성충에 비해 훨씬 낮은 살충률을 보였는데 상대적으로 저농도인 40% 농도의 24°C에서 24시간 처리했을 경우에만 유일하게 100% 살충률을 보여 유층에 대해서는 농도보다는 온도가 중요함을 알 수 있다. 수확한 아스파라거스를 저장하는 온도인 2-4°C에서는 최소한 72시간 동안 고농도의 이산화탄소를 처리하여야만 효과적인 살충을 기대할 수 있다. 이를 위해서는 완전 밀폐된 장소와 이산화탄소를 안정적이고 지속적으로 공급할 수 있는 장치가 필요하다.
친환경유기농자재
곤충병원성 곰팡이인 백강균(Beauveria bassiana)과 Lecanicillium attenuatum은 토양에서 자연적으로 발생하는 곰팡이로 약제 살포가 불가능한 봄 수확기 이전 토양에 존재하는 총채벌레 번데기를 공격하여 초기 총채벌레 밀도를 감소시키는데 큰 도움을 준다. 토양속에 존재하는 파총채벌레의 번데기가 곰팡이 포자에 접촉하게 되면 포자가 발아하여 파총채벌레 번데기의 몸을 뚫고 몸속으로 들어가서 증식하여 죽게 만든다. 최근 연구결과에 따르면 백강균의 파총채벌레에 대한 살충률이 83-100%에 달했으며(Wu et al., 2013), 백강균을 토마토와 오이가 자라는 토양 표면에 처리하였을 때 꽃노랑총채벌레 살충률이 살충제(85%)보다 높은 90%에 이르는 방제가를 보였다(Lee et al., 2017). 또한 백강균은 토양에 처리한 다음 8주경과 후에도 무처리구에 비해 꽃노랑충채벌레 밀도가 70% 낮았다(Zhang et al., 2019).
L. attenuatum은 주로 시설재배 작물의 가장 중요한 해충 중 하나인 진딧물, 특히 복숭아혹진딧물에 대해 우수한 살충력을 가진 곤충병원성 곰팡이로(Kim et al., 2008) 총채벌레류에 대한 살충력도 뛰어나 총채벌레 방제에 이용되고 있으나 실절적인 적용은 미미하다. 국내에서 판매되는 제품을 적용한 연구결과에 따르면 봄 수확기 전 1회 살포는 파총채벌레 밀도를 줄이는데 어느 정도 영향을 끼쳤으나 유의미한 차이를 보이지는 않았다(unpublished data). 따라서 아스파라거스 파총채벌레의 효과적인 방제를 위해서는 곤충병원성 곰팡이를 2-3회 적용하여 토양속에 존재하는 번데기를 제거하여 초기 밀도를 억제해야 한다. 이들 곰팡이는 친환경유기농자재로 등록되어 있어 농약허용물질목록관리제도(PLS)의 적용을 받지 않아 사용이 자유롭다. 그러나 곰팡이는 발아하는데 수분이 필요하므로 포장에 적용 후 충분한 수분공급이 필요하며 또한 살아있는 미생물이므로 고온에서는 포자의 발아율이 크게 저하되기 때문에 기온이 높은 여름에는 사용이 용이하지 않고 봄 수확기에 적용하면 파총채벌레 방제에 도움을 줄 수 있다.
강원도 아스파라거스 파총채벌레 방제를 위한 종합적 방제방안
고급 식재료로 각광받고 있는 아스파라거스는 전국적으로 재배면적 증가추세를 보이며 강원도 지역이 전체 재배면적의 62%를 차지하고 있다. 국내 소비량의 급증에 따라 수입도 늘고 있어 2011년 기준 240톤이 수입되었고 2017년에는 호주, 페루, 태국 등지에서 724톤이 수입되었다(Kang et al., 2017). 국내외 시장에서 가격경쟁력을 갖추기 위해 고품질의 강원도 아스파라거스 생산을 위한 아스파라거스 생육단계별 파총채벌레 종합적 방제방안을 마련하였다.
봄 수확기 전(3월)
강원도의 경우 4월초에 맹아 타파가 시작되고 순생장을 시작한다. 따라서 3월 중순경 미생물살충제인 백강균 및 L. attenuatum을 토양처리 하여 토양 속에 존재하는 파총채벌레 번데기 방제를 통하여 초기 파총채벌레 밀도를 억제한다. 살포한 백강균은 약 40일 동안 활성이 지속되므로 4월말경 추가 살포하여 파총채벌레를 방제한다. 미생물살충제 처리 후 물을 충분히 공급하여 포자 발아가 원활하게 일어나도록 한다.
봄 수확기(4-6월)
봄 수확기에는 아스파라거스를 매일 수확하므로 파총채벌레 밀도가 급격히 증가하지 않는다. 그러나 외부에서 포장 안으로 유입되는 총채벌레가 증가하는 시기이므로 노란색 끈끈이 트랩을 10미터 간격으로 설치하여 총채벌레 밀도를 예찰한다. 또한 백강균 및 L. attenuatum의 추가 살포를 통해 토양 내에 존재하는 파총채벌레 번데기를 공격하여 파총채벌레 밀도를 억제한다.
입경 및 개화(6-9월)
입경이후에는 파총채벌레의 밀도가 급격히 증가하므로 신속한 방제가 요구된다. 아스파라거스에 적용 가능한 살충제중 살충기작이 동일하지 않은 살충제를 선택하여 약 10일 간격으로 교호살포 한다. 또한 살충제를 살포할 때에는 수확한 아스파라거스에 살충제가 잔류하기 때문에 살충제 적용 후 수확한 아스파라거스를 저온저장고에서 3일 이상 저장 후 출고하여야 한다. 살충제 적용이 용이하지 않은 경우에는 500-1,000배 희석한 주방용 세제에 수확한 아스파라거스를 15분간 침지한 후 2회에 걸쳐 흐르는 물에 잘 헹군 후 순을 아래로 향하도록 하여 물기를 충분히 제거한 다음 저온저장고 보관, 출하한다.
요 약
아스파라거스를 가해하는 총채벌레류 해충을 방제하기 위한 방법 중 가장 효과적은 방법은 살충제를 처리하는 것이나 아스파라거스의 경우 매일 수확하기 때문에 수확기에는 살충제 처리가 용이하지 않다. 아스파라거스에 발생하는 해충을 방제하기 위해 적용가능한 살충제는 총 114종이 등록되어 있으며 그 중 총채벌레 방제용 살충제는 60종이 등록되어 있다. 봄 수확기에 살충제를 처리할 경우에는 등록된 약제 살포 3-5일 경과 후 잔류허용기준 또는 정량한계 미만으로 검출되므로 잔류특성이 검증된 약제 살포 후 수확 한 아스파라거스를 저온저장고에 3일 이상 저장 후 출고하면 아스파라거스 농약잔류 안전성에 문제가 되지 않는다. 끈끈이트랩을 이용한 총채벌레 방제시 노란색과 파란색 끈끈이트랩 중 노란색 끈끈이 트랩의 파총채벌레 유인효과가 뛰어났다. 이산화탄소를 이용한 총채벌레 방제의 경우 60% 농도, 20°C, 24시간 또는 40%, 24°C, 24시간 처리 조건일 때 파총채벌레 성충과 유충에 대한 높은 살충효과를 나타냈다. 아스파라거스를 저장하는 2-4°C의 경우에는 고농도의 이산화탄소를 72시간 처리에도 유충이 살아남아 방제효과가 높지 않았다. 곤충병원성 곰팡이인 Beauveria bassiana와 Lecanicillium attenuatum은 토양에서 자연적으로 발생하는 곰팡이로 약제 살포가 어려운 봄 수확기 이전 토양에 존재하는 총채벌레 번데기를 방제하여 초기 총채벌레 밀도를 감소시키는데 큰 도움을 준다.