서 론
재료 및 방법
실험 재료
실험동물 및 실험그룹
자가면역성 신경염(EAN) 유도, Resveratrol의 투여 및 행동학적 관찰
조직 채취
조직학적 분석
면역조직화학 염색
Cytokine 분석
통계 분석
결과 및 고찰
임상 증상
조직병리학적 결과
염증세포 침윤에 대한 평가
iNOS 발현 및 TNF-α Cytokine 측정 결과
요 약
서 론
길랑-바레 증후군(Guillian-Barre syndrom, GBS)은 전 세계적으로 유아부터 고령의 노인까지 다양한 연령에서 발생하고 2주 이내에 중증도의 사지마비와 호흡근 마비가 발생하는 후천성의 자가면역성 질환이다(Sipilä et al., 2017). 이 질환 연구를 위해, 질병 발생의 진행 과정 및 면역학적 기전을 이해하는 것은 치료제 및 치료후보제 발굴에 매우 중요하다(Willison, 2005). 자가면역성 신경염(Experimental Autoimmune neuritis, EAN)은 길랑-바레 증후군의 동물 모델로 CD4+ T 세포 매개의 염증성 말초신경계(peripheral nervous system, PNS) 탈수초성 질환을 특징으로 한다(Zhang et al., 2009). 길랑-바레 증후군의 염증세포의 조절 기전 연구를 목적으로 자가면역성신경염 모델이 활용되고 있으며(Shen et al., 2018; Shin et al., 2013), 질병의 완화 효과를 확인하기 위해 자가면역성신경염 모델을 이용하여 Curcumin(Han et al., 2014), 4-Aminopyridine(Moriguchi et al., 2017), Ginsenoside Rd(Ren et al., 2021b)와 같이 천연물과 화합물 등 다양한 성분을 이용하여 효능 연구한 결과들이 보고되었다.
Resveratrol(trans-3,4,5-trihydroxystilbene)은 루밥(Raal et al., 2009) 및 블루베리(Lyons et al., 2003), 레드 와인(Zhou et al., 2021), 땅콩(Sales and Resurreccion, 2014)과 같은 과일에서 발견되는 천연 폴리페놀로, 다양한 생물학적 활동에 중요한 역할을 한다(Harikumar and Aggarwal, 2014; Pennisi et al., 2017). Resveratrol은 항산화(Cui et al., 2022), 항염증(Meng et al., 2021), 항암(Rauf et al., 2018), 알츠하이머에서 신경염증의 완화(Moussa et al., 2017), 에스트로겐 유사 특성(Malaguarnera, 2019)을 나타낼 수 있다고 알려져 있다.
Inducible nitric oxide synthase(iNOS)는 nitric oxide(NO)를 생산하는 효소로 이러한 효소의 생산과 cytokine의 발현의 증가는 염증과 관련해 병태생리학에 크게 관여한다고 보고되었다(Pautz et al., 2010; Robinson et al., 2011; Yoo and Kwon, 2013). 다발성경화증의 동물모델인 자가면역성뇌척수염의 동물모델에서 pertussis toxin을 투여한 경우, 아급성 염증 증상으로 인한 중추신경계 척수 손상시 iNOS와 TNF-α의 증가가 아급성 염증의 원인 기전으로 보고되었다(Ahn et al., 2001). 또한 자가면역성신경염모델에서 iNOS의 발현은 Schwann cells과 axon의 손상 기전에 아주 중요한 영향을 미친다고 보고되었다(Conti et al., 2004). 또한, iNOS가 결핍된 마우스 및 iNOS 억제 조건에서 수행된 연구들은 inducible NO가 백혈구의 회복 및 유착(Kossmann et al., 2014; Turler et al., 2006), 염증성 질환(Heemskerk et al., 2009; Raposo et al., 2013), 상처 치유(Chin et al., 2011; Most et al., 2002), 혈관 수축에 의한 빈혈(Kane et al., 2001; Silvestre et al., 2000; Garcia-Bonilla et al., 2014), 종양 유도혈관 생성(Lechner et al., 2005)과 같은 다양한 과정을 조절한다고 보고되었다. 또한, NO를 분리하는 화합물은 피하 이식물에 대한 이물 반응을 완화하는 데 효과적 임이 입증되었다(Nichols et al., 2012; Reed et al., 2008). 그러나 말초신경계 염증을 유발하는 자가면역성 신경염 모델에서 Resveratrol의 효과에 대한 연구는 알려진 바 거의 없다. 따라서 본 연구의 목적은 Resveratrol이 자가면역성 신경염에 미치는 영향을 확인하고자 한다.
재료 및 방법
실험 재료
본 실험에 사용된 Resvertrol은 sigmal-aldrich(Seoul, Korea)에서 구입하였으며, 좌골신경 내 염증세포에서 발현하는 iNOS의 발현 정도를 확인하기 위해 rabbit polyclonal anti-iNOS(ABclonal, Boston, USA)를 사용하였고, 좌골신경 내 염증세포의 침윤을 확인하기 위해 Microglia/macrophages의 마커인 rabbit polyclonal anti-ionized calcium-binding molecule-1(Iba-1)(Wako Pure Chemical Industries, Ltd., Osaka, Japan)을 사용하여 좌골신경 염증세포의 발현 정도를 면역조직화학적 기법을 이용하여 분석하였다. 또한 염중성 싸이토카인 분석을 위해 Tumor necrosis factor-alpha(TNF-α) ELISA Kit는 Abcam(Cambridge, UK)에서 구입하여 분석하였다.
실험동물 및 실험그룹
수컷(7-8주령; 160-200 g)의 Lewis 랫드를 대한바이오링크(Chungcheongbuk-do, Republic of Korea)에서 24마리 구입하여 상지대학교 실험동물센터에서 상지대학교 동물실험윤리위원회 가이드라인에 따라 사육하였다. 동물실험은 상지대학교의 실험동물관리 및 사용지침에 따라 진행되었으며, 적응 기간 후 실험동물은 난괴법으로 각 군당 8마리씩(n = 8) 총 3군으로 분류하고 정상 동물과 EAN+PBS 처리 대조군, EAN+Resveratrol(10 mg/kg)투여군으로 나누어 면역 후 14일 동안 경구 투여하였다. 동물 사육실의 온도 및 습도는 24 ± 5°C, 55 ± 5%로 설정하였으며 lighting cycle은 12시간 주기로 자동 조절하였다. 동물실험은 상지대학교 동물실험윤리위원회의 승인 후 연구를 진행하였다(승인번호: 2022-15).
자가면역성 신경염(EAN) 유도, Resveratrol의 투여 및 행동학적 관찰
자가면역성 신경염의 유도는 100 µg SP-26(a neuritogenic peptide homologous to amino acids 53-78 of bovine myelin P2 protein, Shimadzu, Kyoto, Japan) 항원(1 mg/ml)을 Freund’s complete adjuvant(CFA, Mycobacterium tuberculosis H37Ra, 5 mg/ml)와 1:1로 희석하여 뒷 발바닥에 면역하였다. 또한 면역일과 면역 후 2일째에 각 랫트에 pertussis toxin(500 ng, Sigma, St. Louis, MO)을 복강주사하였다.
Resveratrol 투여 그룹에 Resveratrol(10 mg/kg)을 PBS에 희석하여 면역 후 14일 동안 경구 투여하였으며, 모든 그룹에서 체중 및 마비를 매일 측정하였다. 임상증상은 마비의 정도로 평가하였으며, 여섯 등급으로 정상을 Grade(G)0, 꼬리 마비를 G1, 뒷다리의 한쪽 마비를 G2, 양쪽 뒷다리 모두 마비를 G4, 빈사 상태이거나 사망인 경우를 G5, 완전히 회복 단계를 R0로 나누어 평가하였다(Ahn et al., 2006).
조직 채취
조직의 채취는 임상증상 관찰에서 마비가 정점에 이르는 것으로 알려져 있는 면역 후 14일째와 정상으로 회복되는 21일째에 각 지점에서 4마리씩 희생하여 조직을 채취하였다. 아이프란액®(Hana Pharm Co., Ltd. Seoul, Republic of Korea)을 사용하여 마취를 유도한 후, 혈액 분석을 위해 채혈을 진행하였으며, 조직학적 분석을 위해 좌골 신경을 채취하였다.
채취한 좌골신경은 4% Paraformaldehyde에 고정시킨 후 조직처리과정을 거쳐 파라핀 블록으로 포매하였다. 포매 된 조직은 rotary microtome(Leica, Nussloch, Germany)을 이용하여 3 µm의 두께로 절단하였고 조직학적 분석을 진행하였다.
염증성 싸이토카인 분석을 위해 채취된 혈액은 원심분리 후 혈청과 혈구로 분리한 후, 혈청만 cytokine 분석에 사용될 때까지 동결보관하였다.
조직학적 분석
좌골신경을 hematoxylin & eosin 염색으로 조직학적 분석을 진행하였다. 좌골신경 조직 절편(3 µm)을 파라핀을 제거한 후, 10분 동안 hematoxylin으로 염색하였다. 그 다음, 증류수로 헹군 후, 3분 동안 eosin으로 염색하였고, 탈수와 투명화 과정을 거친 후, Balsam(Daejung, Siheung-si, Gyeonggi-do, Korea)으로 봉입 후 현미경으로 관찰하였다.
면역조직화학 염색
좌골신경 절편(3 µm)의 파라핀을 제거하고 citrate buffer(0.01 M, pH 6.0)를 이용하여 전자레인지에서 3분 동안 가열하였다. 실온에서 식인 후, endogenous peroxidase 활성을 차단하기 위해 20분 동안 1% hydrogen peroxide로 처리하였다. Phosphate-buffered saline(PBS)로 2번 세척한 후, 10% normal goat serum(Vector ABC Elite Kit, Burlingame, CA, USA)에 1시간 동안 반응시켰다. 반응 후 1시간 동안 rabbit polyclonal anti-Iba-1(1:400)(Wako Pure Chemical Industries), rabbit polyclonal anti-iNOS(1:200)(ABclonal)를 반응하였고, PBS-T 5분간 3회 세척하였다. 이후 절편을 biotinylated goat anti-rabbit IgG와 avidin-biotin peroxidase complex ABC Elite Kit(Vector)를 45분 동안 각각 반응시킨 후, diaminobenzidine substrate(DAB kit, SK-401; Vector Laboratories)을 사용하여 발색하였다. 발색 후, 절편을 hematoxylin으로 6초 동안 염색하고 증류수에 세척하였다. 탈수와 투명화과정을 거친 후, balsam으로 봉입 후 현미경(BX-51; Olympus, Tokyo, Japan)으로 관찰하였다. 그룹당 발현양을 비교하기 위해 조직 절편 내 항체에 반응한 양성 면적은 Image J 소프트웨어(NIH, Bethesda, MD, USA)를 사용하여 정량적 분석 후 비교하였다.
Cytokine 분석
혈청을 이용하여 Tumor necrosis factor-alpha(TNF-α) 싸이토카인 분석은, ELISA Kit를 사용하여 제조사에서 제안하는 실험방법에 따라 진행하였다(Abcam, Cambridge, UK). 마이크로플레이트 분광 광도계(LTEK, Gyeonggi-do, South Korea)를 450 nm 파장으로 분석하였다.
통계 분석
획득한 데이터들의 통계 분석을 위해 one-way analysis of variance(ANOVA)를 사용하였다. 처리 간 유의성 검정은 분산 분석과 Newman-Keuls test를 실시하였다.
결과 및 고찰
임상 증상
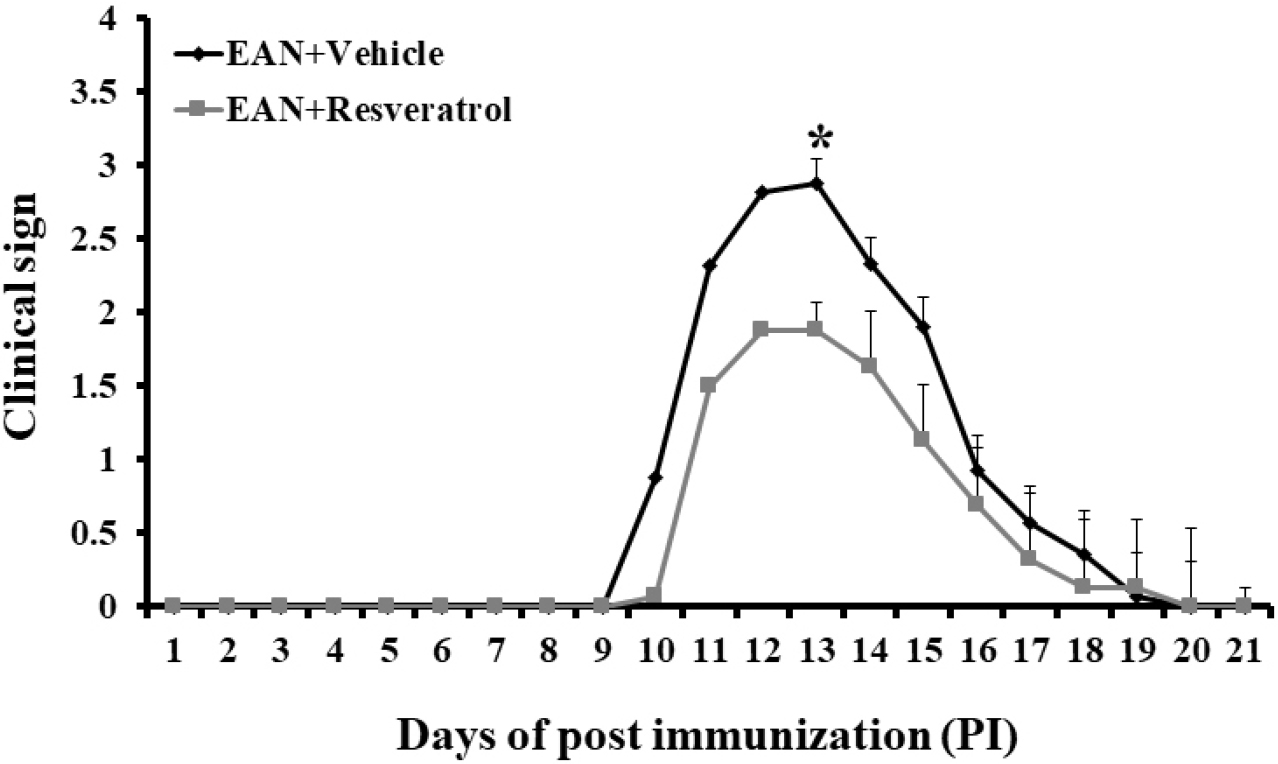
임상 증상을 측정한 결과, 면역 후 10일경에 체중 감소와 함께 꼬리 마비가 시작되는 G1의 임상 증상이 관찰되었다. 면역 후 15일째, 대조군과 Resveratrol 투여군을 비교한 결과, 유의성 있게 임상 증상이 완화되었으며(p < 0.05), 21일경에는 두 그룹 모두 마비 증상이 회복되었다(Fig. 1). 이러한 결과는 Resveratrol 투여에 의해 임상 증상이 완화되었음을 의미한다. Resveratrol의 효능은 항암(Ren et al., 2021a), 항바이러스, 신경보호, 항노화, 항염, 수명 연장(Galiniak et al., 2019) 등의 효능이 확인되었다. Resveratrol의 항산화, 항염효과를 통해 알츠하이머 모델에서 신경보호효과가 보고되었으며(Braidy et al., 2016), Resveratrol의 병용 투여를 통해 알츠하이머 발병을 지연시킬 수 있다는 연구보고는 본 논문의 연구 결과와 마찬가지로 자가면역성 신경염의 임상증상을 완화시킬 수 있다는 의미에 부합한다.
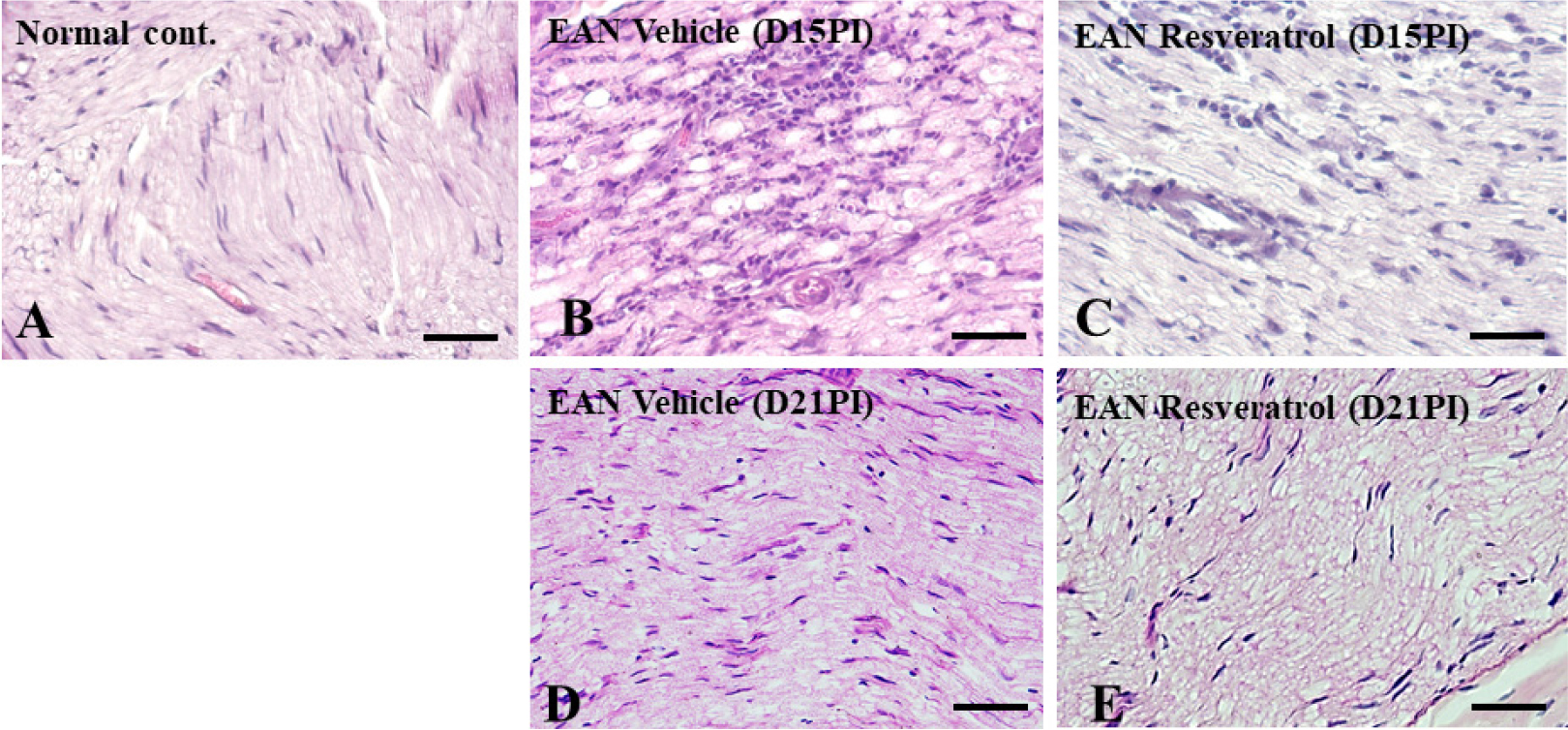
Fig. 2.
Histopathological examination of the sciatic nerve of rats with or without Resveratrol treatment. (A) Normal rats; there was no evidence of inflammatory cells or damaged tissues in the sciatic nerve. (B) Inflammatory cells were detected in the perivascular region and parenchyma of the sciatic nerve in EAN-vehicle-treated rats (D15PI). (C) There were fewer inflammatory cells in EAN-resveratrol (10 mg/kg)-treated rats than in the EAN-vehicle-treated rats. (D). Hematoxylin-eosin staining. Scale bar = 50 um.
조직병리학적 결과
좌골신경의 H&E 염색을 통한 조직학적 분석 결과, 정상 그룹의 좌골신경은 Schwann cells 이 규칙적으로 배열되고 다른 세포의 침윤 없이 정상적인 좌골신경의 구조를 관찰할 수 있었다(Fig. 2A). 자가면역성신경염 유도 후 15일째 좌골신경은 수초탈락 및 염증세포 모양의 세포들이 혈관 주변으로 침윤되어 있는 것을 확인할 수 있었으며(Fig. 2B), Resveratrol 투여그룹의 좌골신경은 이러한 조직학적 소견이 완화되었음을 확인하였다(Fig. 2C). 또한 임상 증상이 완전 회복된 21일째의 소견은 두 그룹에서 모두 염증세포 모양의 세포들이 사라지고 정상조직과 유사한 구조로 확인되었다(Fig. 2D, 2E). 이러한 결과는 Resveratrol의 항암효과 중에는 Natural killer(NK) cells의 활성화를 통해 암세포를 사멸할 수 있다는 결과와 유사하다(Lee et al., 2021).
자가면역성 신경염에서의 NK cells 활성화는 atorvastatin과 함께 처리한 dendritic cells(statin-DCs)을 이용하여 치료효과를 확인하였을 때, 좌골신경 내 염증세포의 수가 감소되었고, CD4+ T cells proliferation이 억제되었으며 NK cells의 수가 증가하여 임상증상이 완화되었다(Xu et al., 2014).
본 연구에서는 비록 CD4+ T cells의 억제와 NK cells의 활성화를 측정하지는 않았지만, Resveratrol의 NK cells을 활성화시킨다는 연구 결과로 볼 때, 자가면역성 신경염 모델에서도 CD4+ T cells의 침윤 억제를 통해 염증세포의 침윤 등 염증매개인자의 발현을 조절했을 것이라고 생각된다.
염증세포 침윤에 대한 평가
면역조직화학 염색 기법을 사용하여 좌골신경 조직 내 micorglia/macriphages의 마커 단백질인 Iba-1 항체를 이용하여 염증세포의 침윤 정도를 그룹별로 비교하였다. 그 결과, 정상그룹의 좌골신경에서는 Iba-1 양성세포의 발현이 거의 관찰되지 않았다(Fig. 3A). 그러나 대조군 그룹의 좌골신경 내 혈관 주변 및 실질 내에 Iba-1 양성 염증세포의 침윤이 증가하였으며(Fig. 3B), Resveratrol 투여 그룹에서는 Iba-1 양성 세포의 발현이 감소됨을 확인하였다(Fig. 3C). 이러한 조직학적 변화를 양적으로 비교한 결과, Iba-1 양성 면적은 정상 그룹의 좌골신경에 비해 대조군에서 유의성 있게 증가하였고(p < 0.001). Resveratrol투여 그룹은 대조군에 비해 유의성 있게 감소한 것을 확인할 수 있었다(p < 0.05)(Fig. 3D). 자가면역성 신경염에서 자가면역 T 세포와 대식세포는 cytokine 분비와 nuclear factor kappa B(NF-κB), mitogen activated protein kinases(MAPK), phospholipase D, caveolins을 포함한 다양한 신호의 활성화를 통해 말초신경에 염증을 유도하는데 아주 중요한 역할을 한다고 알려져 있다(Shin et al., 2013). 이러한 염증세포의 조절 연구는 자가면역성 신경염의 치료 지전으로 아주 유용할 것으로 사료된다. Resveratol의 염증 억제 기전은 흔히 염증의 유발시 활성화된다고 알려져 있는 신호전달 기전인 Arachidonic Acid(AA) pathway, NF-κB 조절, MAPK, activator protein-1(AP-1)의 신호억제를 통해 염증이 억제된다고 보고되었다(Meng et al., 2021). 본 연구에서도 이러한 기전들을 확인하지는 않았지만, 자가면역성신경염에서 위의 기전들이 활성된 보고가 있으며, 이러한 염증 조절 기전을 통해 염증이 억제되었을 것으로 생각된다.
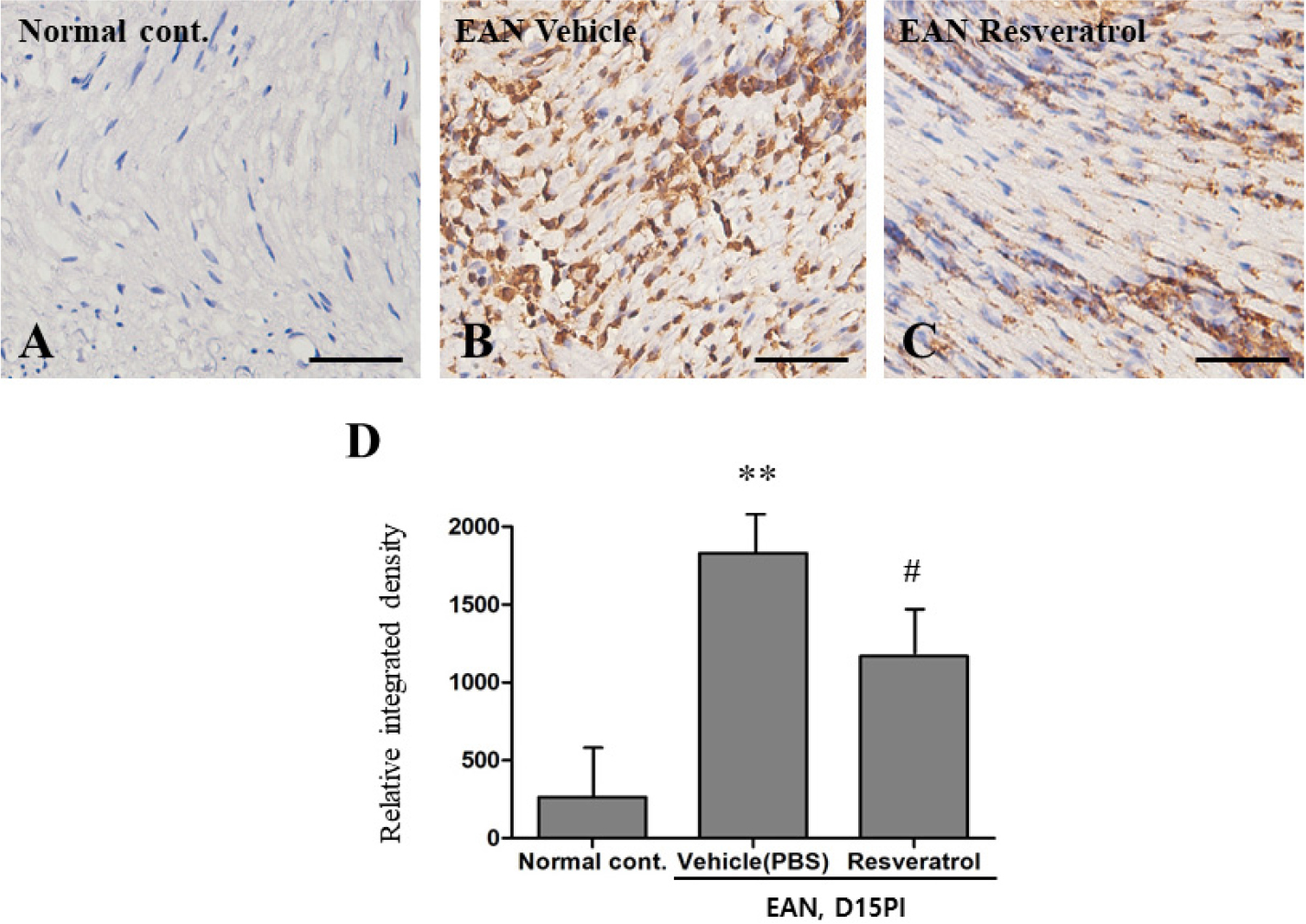
Fig. 3.
Immunohistochemical examination of the sciatic nerve of rats with or without resveratrol treatment (n = 4 per group). Immunohistochemical staining of Iba-1 (A-D). (A) Iba-1-positive cells were rare in the normal sciatic nerve tissue. However, there was an increase in Iba-1-positive immunoreaction in the (B) vehicle-treated group compared to the (C) resveratrol (10 mg/kg)-treated group. (D) The bar graph shows a semi-quantitative analysis of Iba-1-positive areas. Scale bar = 50 um. Data are presented as means ± SEM, *p < 0.05, vs. vehicle treatment group.
iNOS 발현 및 TNF-α Cytokine 측정 결과
면역조직화학 염색 기법을 사용하여 좌골신경 조직 내 iNOS의 발현을 분석하였다(Fig. 4). 그 결과 정상 대조군의 좌골신경에서는 iNOS 양성 세포의 발현이 거의 관찰되지 않았다(Fig. 4A). 그러나 대조군 그룹의 좌골신경에는 iNOS 양성 세포의 발현이 증가하였으며(Fig. 4B), Resveratrol 투여 그룹에서는 iNOS 양성 세포의 발현이 감소됨을 확인하였다(Fig. 4C). 이러한 조직학적 변화를 양적으로 비교한 결과 iNOS 양성 면적은 정상 그룹의 좌골 신경 내 발현에 비해 대조군 그룹에서 유의성 있게 증가하였으며(p < 0.001), Resveratrol투여 그룹에서는 대조군에 비해 유의성 있게 감소한 것을 확인할 수 있었다(p < 0.05)(Fig. 4D).
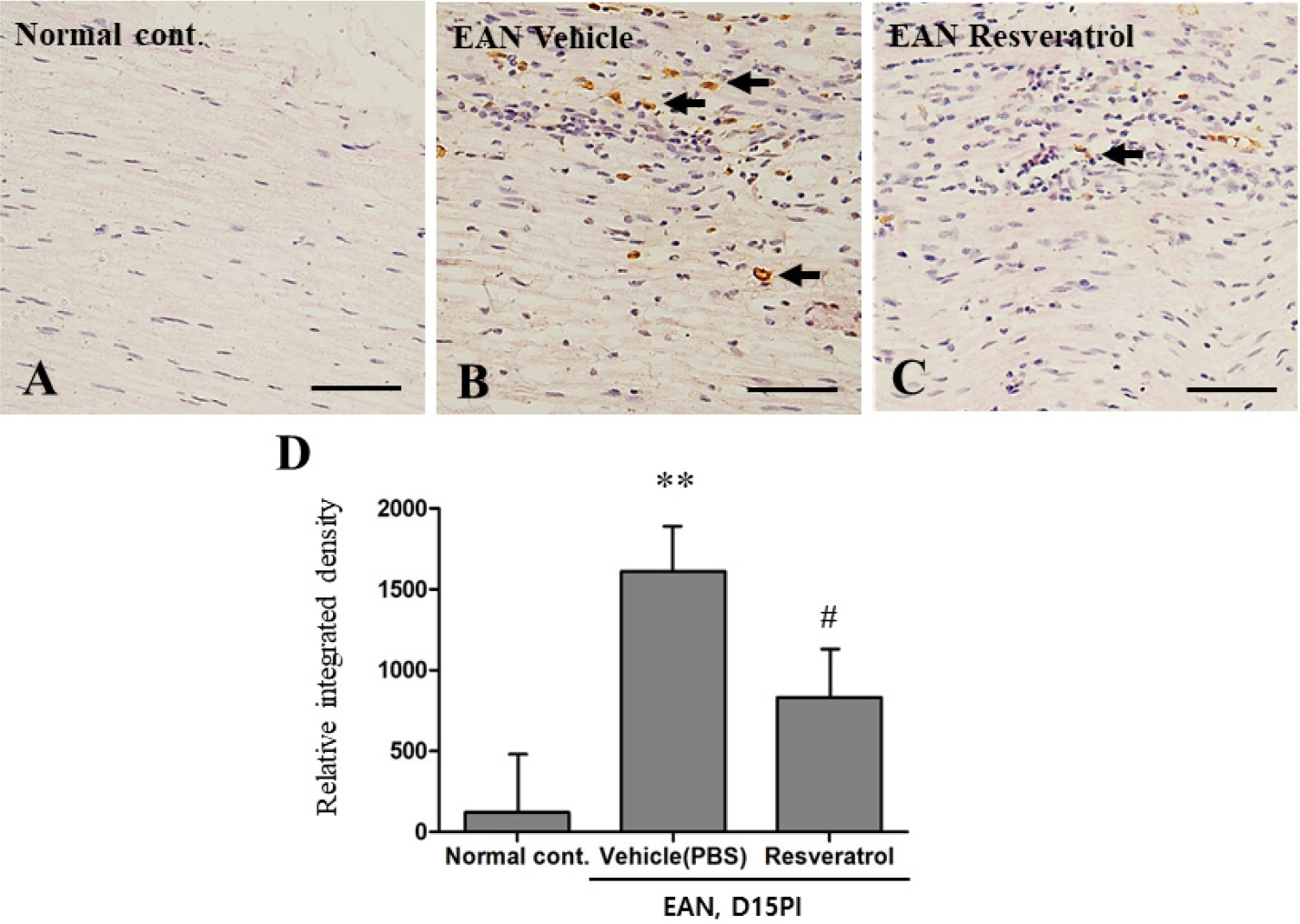
Fig. 4.
Immunohistochemical staining of iNOS in the sciatic nerve tissues of normal and EAN-induced rats (n = 4 per groups). (A) Normal rats: iNOS immunoreactivity is weak. (B) EAN vehicle-treated group: The intensity of the iNOS-positive immunoreaction exhibited an extreme increase. (C) The EAN-resveratrol (10 mg/kg)-treated group exhibits a drastic decrease in the number of iNOS-positive cells. (D) The bar graph shows a semi-quantitative analysis of iNOS-positive areas. Scale bar = 50um. Data are presented as means ± SEM, **p < 0.01, vs. the normal control group. #p < 0.05 vs. EAN-vehicle vehicle-treated rats (D15PI).
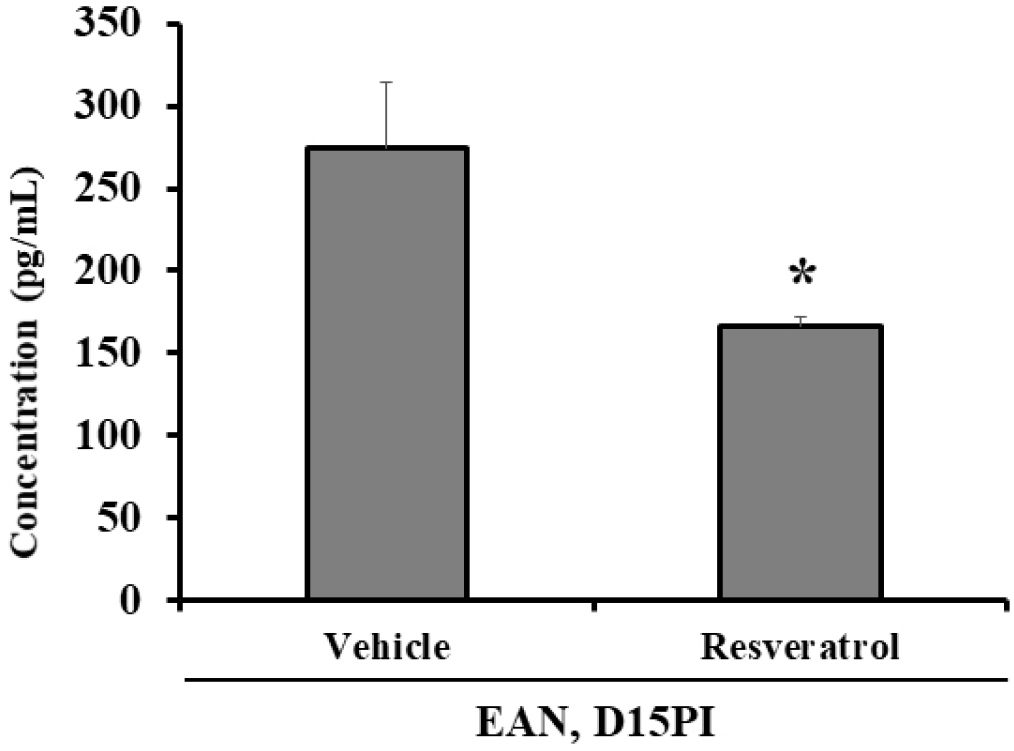
Resveratrol의 염증 반응의 완화 효능을 확인하기 위하여 랫드의 혈청에서 pro-inflammatory cytokine인 TNF-α의 발현 정도를 ELISA로 검사하였다(Fig. 5). 그 결과, 대조군에 비해 Resveratrol을 투여한 그룹에서 TNF-α의 발현이 유의성 있게 감소되었음을 확인하였다(Fig. 5) 따라서, Resveratrol이 염증반응을 조절함으로써 생체 내에서 항염증 효과를 나타낼 수 있음을 시사한다.
본 연구에서 Resveratrol은 염증세포의 침윤과 더불어 iNOS와 TNF-α의 발현을 억제시켰다. 이전 연구에 의하면 자가면역성 뇌척수염 모델에서 pertussis toxin에 의한 hyperacute 동물 모델을 유도한 후, 척수 조직 내 iNOS의 발현을 비교한 결과, 염증 반응이 심하게 유도될수록 iNOS의 발현과 TNF-α의 발현이 심하다는 연구가 보고되었다(Ahn et al., 2001). 또한 자가면역성 신경염 모델에서 iNOS의 발현은 염증세포와 슈완세포에서 발현하였고, 마비증상의 회복기에는 iNOS의 발현이 거의 나타나지 않는다는 연구결과도 보고되었다(Conti et al., 2004).
이러한 연구결과는 iNOS와 TNF-α의 억제는 자가면역성 신경계 질환에서 염증을 완화시키고, 임상증상을 완화시킬 수 있음을 시사한다. 본 연구 결과에서 iNOS의 발현은 염증세포에서만 발현이 확인되었고, Schwann cells에서는 확인되지 않았다는 차이점이 있으나, 임상적으로 완전히 회복한 시기에는 iNOS의 발현이 거의 없다는 결과와는 일치한다. 또한, Resveratrol의 투여는 iNOS와 TNF-α의 발현을 억제시켰고, 그 결과 염증세포의 침윤 억제 및 임상증상의 완화된 결과를 유도하였다는 결과는 이전 보고와 일치하였다.
요 약
본 연구는 자가면역성신경염 동물모델에서 Resveratrol의 효능을 평가하였다. 자가면역성 신경염을 유도하고 Resveratrol(10 mg/kg)을 면역 후, 질병이 유도되는 시기인 14일 동안 경구 투여한 결과, 자가면역성신경염의 임상증상을 완화시켰으며, 좌골신경 조직 내 염증세포의 침윤 억제, iNOS의 발현 및 TNF-α의 발현을 억제시켰다. 이러한 기전에 의해 염증이 유발 기전을 억제하여 치료 효과가 확인되었다. 비록 본 연구에서는 자가면역성 신경염의 질병을 유도하는 CD4+ 림프구의 변화와 다른 종류의 염증 유도 싸이토카인의 변화는 확인하지 못하였지만, 본 연구는 염증의 유도 및 억제에 초점을 맞추었으며 구체적인 조절 기전에 대한 연구는 앞으로 더 진행하고자 한다. 본 연구의 결론은 길랑-바레 증후군의 동물모델인 자가면역성 신경염 모델에서 Resveratrol의 투여는 염증세포 침윤 억제 및 염증 매개물질의 발현 조절을 통해 치료 후보 물질로 활용 가능할 것으로 사료된다.