서 론
재료 및 방법
균 주
배지 및 배양조건
분석방법
통계처리
결과 및 고찰
P. farinosa 균주들의 발효저해제에 대한 내성
발효저해제가 첨가된 배지내의 P. farinosa 균주들의 에탄올 생산
요 약
서 론
최근 원유의 가격상승과 화석연료의 과다한 사용으로 인한 환경문제 등으로 인하여 이를 대체할 친환경 바이오에너지 생산의 필요성이 대두되고 있으며, 전 세계적으로 다양한 연구들이 진행되고 있다(Goshima, 2013; Mclaren, 2005; Eyini, 2004). 바이오에너지는 크게 전분질계와 목질계의 바이오매스로부터 생산되며(Goshima et al., 2013), 생산성과 생산수율이 우수하여 산업적으로 생산되는 바이오에탄올이 대표적이다(Mclaren, 2005). 바이오에탄올은 우수한 인화성으로 인하여 석유의 대체연료로 인정받고 있으나, 옥수수를 비롯한 전분질계 원료를 이용하는 생산기술은 개발도상국들의 식량문제나 자원의 가격상승 등으로 인하여 산업화가 급속하게 확산되지 못하고 있다(Ko, 2008). 따라서 목질계 원료나 볏짚 등의 다양한 셀룰로오스계 바이오매스로부터 바이오에탄올을 생산하는 방법에 관한 연구가 지속적으로 증가하고 있다(Goshima et al., 2013).
셀룰로스계 바이오매스를 미생물을 사용한 바이오에탄올 생산공정에 이용하려면 미생물이 이용할 수 있도록 전처리공정이 필요하며(Cho, 2007; Sassner, 2008), 다당류인 셀룰로오스를 발효가 가능한 당류로 분해하기 위해 주로 산이나 알칼리를 사용하는 화학적 분해법 또는 cellulase를 포함한 효소를 사용하는 효소가수분해법이 사용된다(Ko et al., 2008; Cho et al., 2007; Jeong, 2009; Oh, 1998).
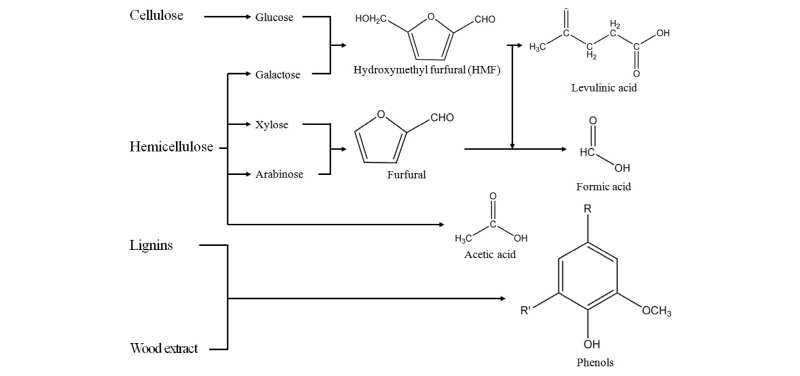
셀룰로오스나 헤미셀룰로스는 전처리공정을 거치며 포도당, 갈락토스와 같은 육탄당, 자일로스와 같은 오탄당으로 분해되지만, hydroxymethyl furfural (HMF), furfural과 같은 퓨란유도체와 formic acid, acetic acid와 같은 약산들이 생성되며(Leif, 2013; Galbe, 2007), 리그닌은 고체잔류물로 존재하거나 페놀류 및 다른 방향족 화합물로 분해된다(Leif et al., 2013; Arantes, 2011). 이러한 성분들의 생성으로 인하여, 발효미생물의 생육과 에탄올생성이 억제된다(Fig. 1) (Almeida, 2007; Larsson, 1999).
효모는 오래 전부터 주류 생산공정에 사용되었으며, 최근 바이오에탄올 생산 공정에도 사용되고 있다(Eyini et al., 2004; Lee, 2014). 에탄올 발효공정에는 에탄올 생산성이 우수한 Saccharomyces 와 Pichia속이 가장 많이 사용된다(Lee et al., 2014; Mielenz, 2001). 따라서 바이오매스를 기질로 사용하여 에탄올을 경제적으로 생산하기 위해서는 발효저해제에 대한 내성이 우수한 효모균주를 확보하는 것이 매우 중요하다(Almeida et al., 2007).
누룩으로부터 분리한 효모인 P. farinosa KCTC27753 (Kwon, 2016) 균주는 고온에서 성장이 우수하며, 산과 삼투압에 대한 내성이 우수하여 에탄올 생산공정에 요구되는 특성을 지닌 균주이다(Novak, 1981). 본 연구에서는 P. farinosa KCTC27753의 발효저해제에 대한 내성을 확인하여 바이오매스로부터 바이오에탄올을 생산하는데 필요한 기반자료를 확보하고자 하였다.
재료 및 방법
균 주
누룩으로부터 분리되었으며, 46°C, pH 3에서 성장이 가능한 P. farinosa KCTC27753 균주를 사용하였다(Kwon and Kim, 2016). 대조구로서 P. farinosa KCTC27412 및 CBS7064균주를 한국미생물자원센터(KCTC, Daejeon, Korea), Centraalbureau voor Schimmelcultures (CBS, Netherlands)로부터 각각 분양 받아 사용하였다.
배지 및 배양조건
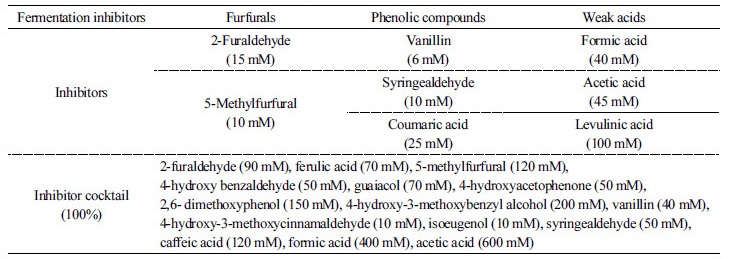
P. farinosa CBS7064, KCTC27412, 27753 균주의 발효저해제에 대한 내성을 시험하기 위하여(Lee, 2013), 각 균주의 단일 집락을 5 mL YEPD (yeast extract 10 g/L, peptone 20 g/L glucose 20 g/L, pH 6.8, BD Diagnostic, USA) 배지에 접종하여 30°C에서 12시간 배양한 후, 600 nm에서의 세포흡광도(OD600)가 0.2에 해당하는 균체를 회수하였다. 균체는 멸균수로 5회 세척하고 100부터 10-4까지 단계적으로 멸균수를 사용하여 희석한 후 사용하였다. 희석액은 다양한 농도의 발효저해제가 첨가된 YEPD 평판배지에 10 µL씩 점적한 후30°C에서 48시간 동안 배양하였다. 발효저해제는 Sigma-Aldrich (USA) 로부터 구매하였으며, 저해제의 종류 및 농도는 Table 1에 나타내었다.
발효저해제 혼합물(inhibitor cocktail)이 16 g/L의 농도로 첨가된 배지에서 P. farinosa 균주들의 균주의 생육과 포도당 소모특성을 조사하기 위하여 단일 집락을 50 mL의 YEPD 배지에 접종하고 30°C에서 12시간 동안 전배양하였다. 배양된 균주는 원심분리를 통하여 회수한 후 멸균수로 세척하고 세포흡광도가 0.1이 되도록 발효저해제 혼합물이 첨가된 200 mL의YEPD 배지에 접종하고 진탕배양기(JSR, Korea)를 사용하여 30°C 에서 200 rpm의 교반속도로 72 시간 동안 배양하였다.
분석방법
균주의 성장은 흡광광도계(Ultrospec 6300 pro, GE Healthcare, Sweden)를 사용하여 600 nm에서 흡광도를 측정하여 결정하였다. 포도당 및 에탄올의 농도는 굴절률 검출기(RID-10A, Shimadzu, Japan)가 장착된 고성능 액체 크로마토그래프(HPLC 20A-Series, Shimadzu)를 사용하여 측정하였다. 컬럼은 Rezex ROA-Organic Acid H+ (Phenomenex, USA)를 사용하였으며, 이동상으로서 0.005 N H2SO4 용액을 0.6 mL/min의 유속으로 사용하였다.
통계처리
모든 측정은 3회 반복하였으며 평균값과 표준오차는 IBM SPSS Statistics 21 (IBM, USA)를 사용하여 결정하였고 유의성 검증은 일원배치 분산 분석법을 이용하였다(Wu, 2007).
결과 및 고찰
P. farinosa 균주들의 발효저해제에 대한 내성
누룩으로부터 분리한 P. farinosa KCTC27753 균주의 발효저해제에 대한 내성을 대조구 균주들과 비교하기 위해, 다양한 발효저해제가 첨가된 YEPD 평판배지를 사용하여 균체의 성장을 비교하였다(Fig. 2).

Fig. 2. Growth of P. farinosa strains on YEPD plates containing fermentation inhibitors. Cells growing exponentially at 30°C were diluted to an OD600 of 0.2 with sterile YEPD. Ten-fold serial dilutions were then prepared, and 10 µL of each dilution was spotted. The plates were incubated at 30°C, and cell growth was assessed after 2 days.
YEPD 배지에서 세 균주 모두 유사한 성장을 나타내었다. YEPD 배지에서의 성장 결과와 비교하였을 때, furfural 계열의 2-furaldehyde이 첨가된 배지에서 KCTC27753 균주는 대조구에 비해 상대적으로 낮은 균체성장을 나타내었으며, 10 mM의 5-methylfurfural이 첨가된 배지에서는 유사한 성장을 나타내었다. Phenolic compound가 첨가된 배지에서, CBS7064 균주는 성장하지 못하였으며, vanillin과 syringealdehyde가 첨가된 배지에서 KCTC27753 균주가 대조구 균주에 비해 우수한 성장을 나타내었다. Weak acid가 첨가된 배지에서도 phenolic compound가 첨가된 배지와 마찬가지로 CBS7064 균주는 성장하지 못하였으며, P. farinosa KCTC27412에 비해 KCTC27753 균주가 우수한 성장을 나타내었다. 발효저해제 혼합물이 1.3%로 첨가된 배지에서는 대조구와 KCTC27753 균주의 성장에 유의적인 차이가 나타나지 않았으나, 1.6%로 첨가된 배지에서는 KCTC27753 균주의 성장이 상대적으로 우수하였다.
발효저해제가 첨가된 배지내의 P. farinosa 균주들의 에탄올 생산
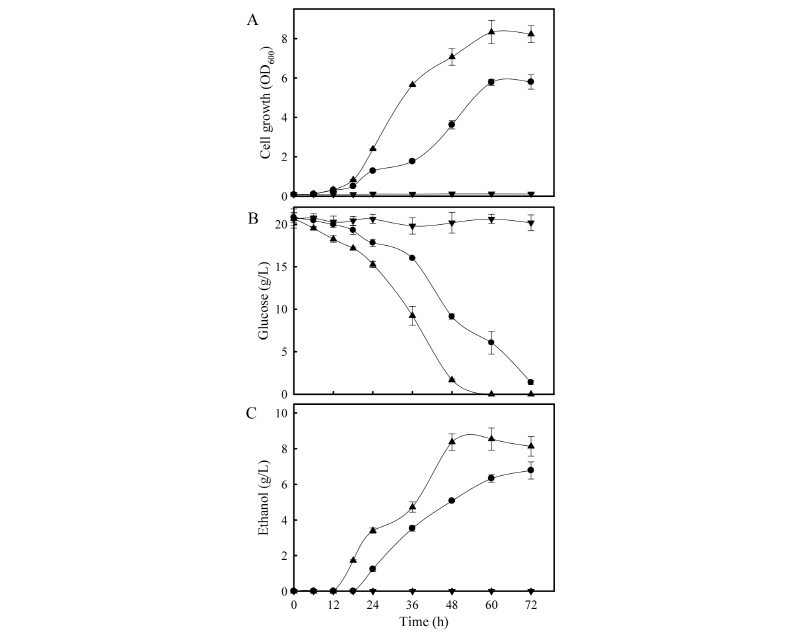
발효저해제 혼합액이 1.6%로 첨가된 YEPD 배지에서, P. farinosa KCTC27753 균주와 대조구 균주들의 포도당 소모, 균체성장 및 에탄올 생산특성을 조사하였다(Fig. 3).
P. farinosa KCTC27753 균주가 최대로 성장하였을 때는 발효 개시 후 60시간이었으며, 8.33 ± 0.59의 세포흡광도를 나타내었으며, 이는 대조구 균주인 KCTC27412 균주에 비해 약 1.4배 가량 우수한 수준이었다(Fig. 3A). 발효 개시 후 60시간이 경과하였을 때, 초기에 첨가된 20 g의 포도당이 모두 소모되었고 8.54 ± 0.51 g의 에탄올이 생성되어 약 42%의 에탄올 생산수율을 나타내었으며, 이러한 결과는 약 18.6 g의 포도당을 소모하여 6.78 ± 0.51 g의 에탄올을 생성하여, 약 36%의 에탄올 생산수율을 나타낸 KCTC27412 균주에 비해 약 1.2배 가량 높은 것으로 나타났다(Fig. 3B, C). P. farinosa CBS7064 균주의 경우 발효저해제가 첨가된 고체 및 액체배지에서 균체의 성장 및 포도당 소모, 에탄올 생산이 나타나지 않았는데, 이는 phenolic compound, weak acid 계열의 저해제가 균체의 생육을 억제하였기 때문인 것으로 사료된다.
바이오매스의 전처리를 통해서 생성된 발효저해제를 제거하거나 감소시키기 위해, 음이온 교환법이나, 아황산염, 라카아제 등이 사용된다(Koppram, 2012). 그러나 이러한 방법들은 발효에 필요한 탄소원의 양을 감소시켜 결국 바이오에탄올 생산수율을 감소시키는 결과를 초래한다(Larsson, 1999). 이러한 문제점을 해결하기 위하여 최근에는 발효저해제에 대한 내성이 우수한 미생물을 분리하거나(Zh, 2012) 실험실적 진화방법(Koppram et al., 2012)을 통하여 바이오에탄올 생산성이 우수한 미생물의 저해제 내성을 증진시키는 등의 연구가 시도되고 있다.
따라서 기존에 보고된 균주에 비해, 고온 및 저해제에 내성이 우수한 효모인 P. farinosa KCTC27753은 가수분해물을 사용한 바이오에탄올 생산공정에 적용할 가능성이 높은 균주로 사료된다.
요 약
P. farinosa KCTC27753균주의 발효저해제에 대한 내성을 확인하였다. P. farinosa KCTC27753은 누룩으로부터 분리된 균주이며, 46°C, pH 3조건에서 성장이 가능한 스트레스 내성 균주다. KCTC27753균주의 발효저해제에 대한 내성을 확인하기 위해, furfural, phenolic compound, weak acid와 같은 발효저해제가 첨가된 배지를 사용하여 균체의 성장 및 에탄올 생산성을 확인하였다. P. farinosa KCTC27753 균주는 대조구인 P. farinosa KCTC27412, CBS7064 균주에 비하여 HMF, vanillin, 및 phenolic compound가 첨가된 배지에서 우수한 균체성장을 나타내었다. 발효저해제에 혼합물이 1.6% 첨가된 배지에서 P. farinosa KCTC27753 균주는 20 g의 포도당으로부터 8.54 ± 0.51 g/L의 에탄올을 생산하여 소모한 포도당 대비 약 42%의 에탄올 생산수율을 나타냈다.